План лекции:
1. Общая характеристика кислородсодержащих соединений
2. Метанол
3. Этанол
4. Фенол
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на:
· одноатомные (одна группа -ОН)
Например: СH3 – OH метанол; CH3 – CH2 – OH этанол
· многоатомные (две и более групп -ОН).
а) двухатомные спирты. Например: HO–СH2–CH2–OH этиленгликоль (этандиол).
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
б) трехатомные спирты. Например: HO–СH2–СН(ОН)–CH2–OH глицерин (пропантриол-1,2,3).
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты:
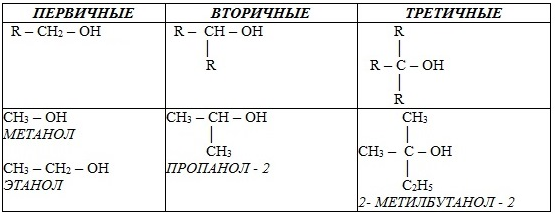
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
Ø предельные (метанол СH3 – CH2–OH)
Ø непредельные (пропен 2 – ол 1 CH2=CH–CH2–OH)
Ø ароматические (фенилметанол или бензиловый спирт C6H5CH2–OH)
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Предельные одноатомные спирты – это кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH), имеющие общую формулу: CnH2n+1OH или ROH
Первым членом гомологического ряда спиртов является метанол Н3С–ОН, каждый последующий член гомологического ряда отличается на группу СН2.
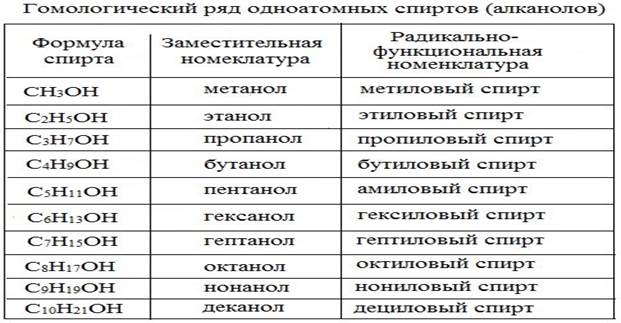
Систематические названия даются по названию углеводорода с добавлением суффикса –ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Нумерация ведется от ближайшего к ОН-группе конца цепи. Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
Например:
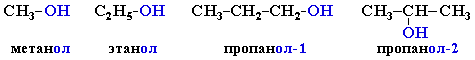
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт".
Метанол
Метанол – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. бесцветная жидкость (т. кип. 64,5 °С, плотность 0,79), смешивающаяся во всех соотношениях с водой и многими органическими растворителями. Метиловый спирт ядовит, он горит бледно-голубым некоптящим пламенем, по запаху и вкусу почти не отличается от этилового.
Метиловый спирт широко используется в промышленности как растворитель лаков, красок, как исходное вещество для получения многих химических соединений. Он применяется для денатурации этилового спирта, входит в состав антифриза.
Метиловый спирт может поступать в организм через пищевой канал, а также с вдыхаемым воздухом, содержащим пары этого спирта. В незначительных количествах метиловый спирт может проникать в организм и через кожу. Токсичность метилового спирта зависит от обстоятельств отравления и индивидуальной восприимчивости. Под влиянием метилового спирта происходит поражение сетчатки глаза и зрительного нерва, от воздействия 4,0 – 7,0 метанола наступает неизлечимая слепота. Метиловый спирт нарушает окислительные процессы и кислотно-щелочное равновесие в клетках и тканях. В результате этого наступает ацидоз. Отравление метиловым спиртом в ряде случаев заканчивается смертью и смертельная доза спирта составляет 30—100 мл. Смерть наступает в результате остановки дыхания, отека головного мозга и легких, коллапса или уремии. Местное действие метилового спирта на слизистые оболочки проявляется сильнее, а наркотическое действие — слабее, чем у этилового спирта, так как метанол не вызывает чувства опьянения. Одновременное поступление метилового и этилового спиртов в организм уменьшает токсичность метилового спирта. Это объясняется тем, что этиловый спирт уменьшает скорость окисления метилового спирта почти на 50 %, а следовательно, и уменьшает его токсичность.
Метиловый спирт, поступивший в организм, распределяется между органами и тканями. Наибольшее количество его накапливается в печени, а затем в почках, наименьшие – в мышцах, жире и головном мозгу. Метаболитом метилового спирта является формальдегид, который окисляется до муравьиной кислоты. Часть этой кислоты разлагается на оксид углерода (IV) и воду.
Качественное обнаружение
Для обнаружения метилового спирта применяют ограниченное число реакций на этот спирт. Большинство из них проводят после переведения его в формальдегид.
1. Окисление метилового спирта. Большинство реакций обнаружения метилового спирта основано на окислении его до формальдегида и определении последнего при помощи реакций окрашивания. Прежде чем приступить к окислению метилового спирта до формальдегида, необходимо проверить наличие этого альдегида в исследуемом растворе.
Для окисления метилового спирта в формальдегид применяют перманганат калия или другие окислители:
5СН3ОН + 2КMnО4 + 3H2SO4→ 5НСНО + 2MnSO4 + K2SO4 + 8Н2О.
При взаимодействии ионов марганца с избытком перманганата калия может образоваться оксид марганца (IV):
3Mn 2+ + 2MnO 4- + 2Н2О → 5MnO 2 + 4Н +.
Для связывания избытка перманганата калия и оксида марганца (IV) прибавляют сульфит натрия или другие восстановители (гидросульфит натрия, щавелевую кислоту и др.).
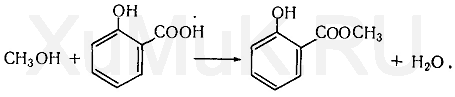
2. Реакция образования метилсалицилата. При наличии метилового спирта в исследуемом растворе ощущается характерный запах метилового эфира салициловой кислоты:
Количественное определение
Для количественного определения метанола применяют колориметрический метод, основанный на образовании окрашенного продукта при взаимодействии формальдегида с фуксинсернистой кислотой.
5СН3ОН + 2КMnО4 + 3H2SO4→ 5НСНО + 2MnSO4 + K2SO4 + 8Н2О.
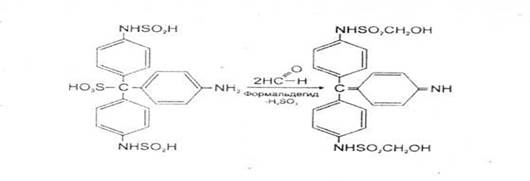
Этанол
Этанол – бесцветная, прозрачная, летучая жидкость, с характерным запахом, жгучая на вкус (т. кип. 77—77,5 °С). Этиловый спирт горит синеватым пламенем, смешивается во всех соотношениях с водой, диэтиловым эфиром и многими другими органическими растворителями, перегоняется с водяным паром.
Этиловый спирт широко используется в промышленности как растворитель и исходный продукт для получения многих химических соединений. Этот спирт используется в медицине как дезинфицирующее средство. В химических лабораториях он применяется как растворитель, входит в состав многих спиртных напитков.
Этиловый спирт может поступать в организм несколькими путями: при приеме внутрь, при внутривенном введении, а также через легкие в виде паров с вдыхаемым воздухом. Поступивший в организм этиловый спирт действует на кору головного мозга: сначала возбуждает, а затем парализует ЦНС. В больших дозах этиловый спирт вызывает угнетение функций как спинного, так и продолговатого мозга. При этом может наступить состояние длительного глубокого наркоза с потерей рефлексов и угнетением жизненно важных центров. Под влиянием этилового спирта может наступить смерть в результате паралича дыхательного центра. Этанол не только вызывает острые отравления, но и способствует скоропостижной смерти от других заболеваний (прежде всего, от заболеваний сердечно-сосудистой системы).
Степень токсичности этанола зависит от дозы, концентрации его в напитках, от наличия в них сивушных масел и других примесей, прибавляемых для придания напиткам определенного запаха и вкуса. Ориентировочно смертельной дозой для человека считается 6—8 мл чистого этилового спирта на 1 кг массы тела. В пересчете на всю массу тела это составляет 200—300 мл этилового спирта. Однако эта доза может изменяться в зависимости от чувствительности к этиловому спирту, условий его приема (крепость напитков, наполненность желудка пищей) и т. д. Этанол относится к наркотическим веществам. Длительное злоупотребление этиловым спиртом приводит к хроническому отравлению. Повторные приемы алкоголя приводят к развитию привыкания, одновременно с привыканием вырабатывается пристрастие, а затем развивается алкогольная зависимость (алкоголизм), которая характеризуется тягостными переживаниями без употребления алкоголя и сильным желанием повторных его приемов.
В результате длительных приемов этилового спирта происходит ряд тяжелых нарушений функций организма: может наступить цирроз печени, перерождение сердечной мышцы и почек, стойкое расширение сосудов лица (особенно сосудов носа), дрожание мышц, галлюцинации, буйный бред (белая горячка) и т.д.
Этиловый спирт неравномерно распределяется в тканях и биологических жидкостях организма, что зависит от количества воды в них. Учитывая большой объем крови в организме, в ней накапливается значительно большее количество спирта, чем в других органах и тканях. Поэтому определение этанола в крови имеет большое значение для оценки количества этого спирта, поступившего в организм, также при оценке результатов количественного определения необходимо учитывать, что этот спирт может образовываться при гнилостном разложении трупов. В отличие от крови в моче трупов образование этилового спирта не происходит. Поэтому для оценки степени опьянения производят определение этилового спирта как в крови, так и в моче.
До 10% этилового спирта выделяется из организма в неизмененном виде с мочой, выдыхаемым воздухом, потом, слюной и т.д Остальное количество этого спирта подвергается метаболизму несколькими путями: определенное количество окисляется с образованием воды и оксида углерода (IV); большая часть окисляется до уксусного альдегида, а затем до уксусной кислоты.
Качественное обнаружение
1. Реакция образования йодоформа. При нагревании этилового спирта с раствором йода в щелочной среде образуется йодоформ, имеющий специфический запах. При относительно больших количествах этилового спирта в пробе образуются кристаллы йодоформа, имеющие форму шестиугольников и звездочек.
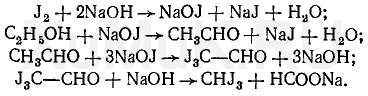
Предел обнаружения: 0,04 мг этилового спирта в 1 мл раствора. Эта реакция не специфична на этиловый спирт. Ее дают ацетон, молочная кислота и др.
2. Реакция образования уксусно-этилового эфира (этилацетата). Этиловый спирт с ацетатом натрия в присутствии серной кислоты образует уксусно-этиловый эфир, имеющий характерный запах:
2CH3COONa + 2C2H5OH + H2SO4 → 2СН3СООС2Н5 + Na2SO4 + 2H2O.
Запах уксусно-этилового эфира более отчетливо ощущается, если содержимое пробирки вылить в 20—25-кратный объем воды
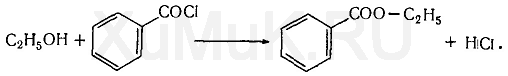
3. Реакция образования этилбензоата. При взаимодействии этилового спирта с бензоилхлоридом (хлористым бензоилом) образуется этилбензоат, имеющий характерный запах:
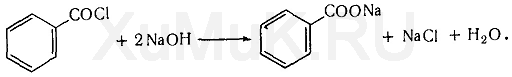
Распознаванию запаха этилбензоата мешает избыток бензоилхлорида, имеющего неприятный запах. Поэтому для разложения избытка бензоилхлорида прибавляют раствор щелочи:
4. Реакция образования ацетальдегида (уксусного альдегида). Этиловый спирт окисляется дихроматом калия, перманганатом калия и некоторыми другими окислителями до ацетальдегида, имеющего характерный запах.
ЗС2Н5ОН + К2Cr2O7 + 4H2SO4 →3СН3СНО + Cr2(SO4)3 + K2SO4 + 7Н2О
Количественное определение
Количественное определение этанола производится несколькими методами: 1) этилнитритным; 2) методом Видмарка в модификации Шоймоша; 3) фотометрическим; 4) газохроматографическим.
Этилнитритный метод основан на переведении этилового спирта в сложный эфир этилнитрит, омылении его и последующем определении азотистой кислоты – одного из продуктов омыления этилнитрита.
NaNO3 + HCl = NaCl + HNO2;
C2H5ОH + HONO = H2O + C2H5ONO + Н2О
Определение этилового спирта микрометодом Видмарка в модификации Шоймоша. Метод был разработан для определения этанола в крови живых лиц. Принцип микрометода состоит в том, что в колбе определенной конструкции спирт из взятой навески крови отгоняют в присутствии смеси бихромата калия с концентрированной серной кислотой. Спирт вступает в реакцию с бихромтом калия и окисляется до уксусной кислоты, а бихромат калия восстанавливается. Исходя из количества бихромата калия, взятого до анализа и оставшегося неизмененным после реакции со спиртом, вычисляют количество его, пошедшее на окисление поглощенного из крови спирта. Фотометрический метод определения этилового спирта основан на ускоренной изотермической диффузии этилового спирта из объекта исследования (кровь, моча) под действием карбоната калия. Спирт восстанавливает бихромат калия в кислой среде; окраска последнего изменяется от светло-желтой до темно-синей. По градации переходных оттенков фотометрированием по отношению к эталонным растворам этилового спирта и к контрольной пробе (дистиллированная вода) определяется содержанием спирта в объектах исследования.
Определение методом газо-жидкостной хроматографии обладает неоспоримыми преимуществами перед химическими методами определения этилового спирта, так как является специфичным, сравнительно точным – чувствительность метода составляет 0,01%, объективным и доказательным. Газо-жидкостная хроматография позволяет разделить спирты – метиловый, этиловый, пропиловый, бутиловый и изоамиловый друг от друга в присутствии других летучих веществ, дать выделенным спиртам качественную и количественную характеристику.
Фенол
Фенол – представляет собой тонкие длинные игольчатые кристаллы или бесцветное легкоплавкое кристаллическое вещество, с характерным запахом, быстро розовеющее на воздухе вследствие окисления. Фенол растворяется в воде в соотношении (1:20), легко растворяется в этиловом спирте, диэтиловом эфире, хлороформе, жирных маслах, растворах едких щелочей.
Если ароматическое кольцо содержит одну гидроксильную группу, то это одноатомные фенолы:
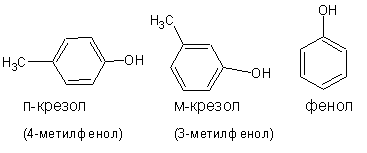
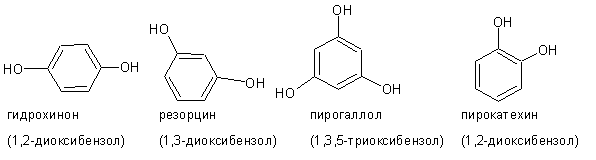
При наличии двух и более гидроксильных групп фенолы называют, соответственно, двух-, трехатомными и т.д.
Фенолы применяются для изготовления искусственных смол, являются исходным продуктом для синтеза некоторых органических красителей, салициловой кислоты, пикриновой кислоты, применяются для дезинфекции и дезинсекции. Они используются и в качестве инсектицидов, антиоксидантов, химических реактивов и т. д. Одноатомные фенолы, в частности карболовая кислота, ядовиты и изредка имеют место умышленные отравления ею, встречаются отравления ив результате смешения ее с другими веществами.
Широкое применение фенолов в производстве пластических масс, попадание их в воздух при недостаточной вентиляции могут привести к промышленным отравлениям. При приемах фенола внутрь он быстро всасывается, отравление им протекает бурно. Наблюдаются жжение и боль в желудке и кишечнике, рвота беловатыми хлопьевидными массами, понос, иногда с примесью крови, ощущается запах фенола изо рта и от рвотных масс. Моча больного, отравленного фенолом, имеет оливковый или черно-оливковый цвет. Смертельной дозой фенола при приемах внутрь считают 8 - 15 г. При вскрытии трупов ощущается запах фенола, слизистая оболочка рта, пищевода и желудка покрыта молочно-мутного цвета пятнами, жесткими на ощупь. Отмечаются белковое, а затем жировое перерождение органов, мелкие кровоизлияния во внутренних органах и в тканях мозга. Из организма фенолы выводятся с мочой.
Качественное обнаружение
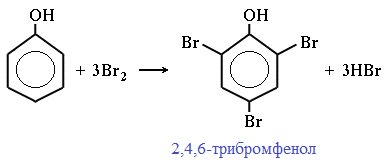
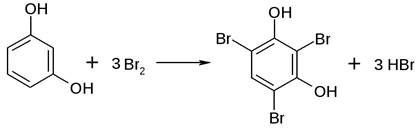
Реакция галогенирования. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола:
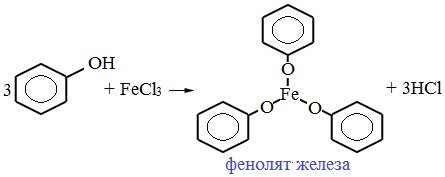
Реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
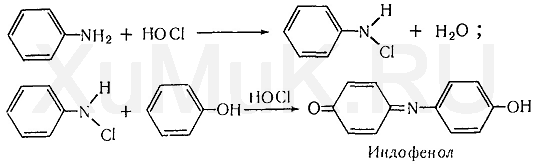
Индофеноловая реакция. При окислении смеси фенолов и аминов образуются индофенолы, имеющие соответствующую окраску:
Количественное определение
Для количественного определения дистилляцию производят до тех пор, пока качественные реакции (с бромной водой) не покажут отсутствия фенола.
1. При достаточном количестве фенола, о чем можно судить
по результатам качественных реакций, может быть произведено
весовое определение его в виде трибромфенола.
2. При малых количествах фенола возможно лишь объемное
броматометрическое определение К веществу добавляют избыток титрованного раствора калия бромата и калия бромида, раствор подкисляют серной или хлороводородной кислотой. Образующийся бром вступает в реакцию замещения с фенолом. Через 10-15 минут избыток брома определяют йодометрическим методом: добавляют калия йодид и выделившийся йод титруют раствором натрия тиосульфата (индикатор - крахмал). КBrO3 + 5 КВr + 3 Н2SО4 → 3 Вr2 + 3 К2SО4+ 3 Н2О
Избыток Br2 + 2 KI → I2 + 2 KBr
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
 2020-08-05
2020-08-05 167
167








