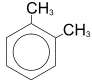
Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Нумерацию начинают с одного из заместителей так, чтобы сумма номеров заместителей была минимальна. Если соединение содержит два заместителя у бензольного кольца, то располагаться они могут тремя разными способами друг относительно друга. Положение двух заместителей указывают с помощью приставок: орто - (о-), если они находятся у соседних углеродных атомов (положение 1, 2-), мета - (м-) для разделенных одним атомом углерода (1, 3-) и пара - (п-) для находящихся напротив друг друга (1, 4-). Например, для диметилбензола (ксилола):
орто-ксилол (1,2-диметилбензол)
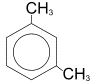
| мета-ксилол (1,3-диметилбензол)
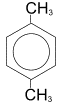
| пара-ксилол (1,4-диметилбензол)
|
Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил.
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода вих молекулах. Бензол – яд, легкокипящая (tкип = 80,1°С), бесцветная жидкость, не растворяется в воде, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом. Большинство ароматических углеводородов опасны для жизни, токсичны.
Химические свойства
Ароматическая связь определяет химические свойства бензола и других ароматических углеводородов. Несмотря на наличие существенной степени ненасыщенности, ароматические соединения не вступают в реакции присоединения, характерные для алкенов. Вместо этого имеют место реакции замещения, когда один или несколько атомов водорода при кольце замещаются на другие атомы или группы атомов. Эти и другие реакции, протекающие с бензоидными ароматическим соединениями, можно классифицировать следующим образом.
1. Реакции окисления:
а) горение (полное). На воздухе бензол горит сильно коптящим пламенем из-за неполного сгорания.
2C6H6 + 15O2  12CO2 + 6H2O
12CO2 + 6H2O
C6H5—CH3 + 9O2  7CO2 + 4H2O
7CO2 + 4H2O
б) неполное окисление толуола раствором перманганата калия.
C6H5—CH3 + 3[O]  C6H5—COOH + H2O
C6H5—COOH + H2O
2. Реакции замещения:
а) галогенирование. При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода ядра замещается галогеном.
 + Cl2 –AlCl3
+ Cl2 –AlCl3 
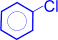 (хлорбензол) + H2O
(хлорбензол) + H2O
C6H5—CH3 + 3Br2 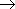
| 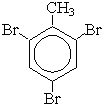
| + 3HBr |
У гомологов бензола галогенирование на свету приводит к замещению атомов водорода в радикале.
C6H5—CH3 + Cl2  C6H5—CH2Cl + HCl
C6H5—CH2Cl + HCl
б) нитрование:
C6H6 + HONO2 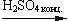 C6H5—NO2 + H2O (смесь орто- и пара- изомеров)
C6H5—NO2 + H2O (смесь орто- и пара- изомеров)
| C6H5—CH3 + 3HONO2(конц.) | 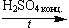
| 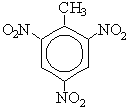
| + 3H2O |
3. Реакции присоединения:
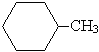
а) гидрирование:
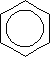
| + 3H2 | 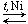
| 
| |
| C6H5—CH3 +3H2 | 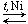
| 
| ||
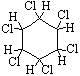
б) галогенирование протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6)
| C6H6 + 3Cl2 | 
| 
|
 2020-08-05
2020-08-05 116
116








