Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникает направленное движение электронов электрический ток. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются химическими источниками тока или гальваническими элементами.
Всякий гальванический элемент состоит из двух электродов, соединенных между собой металлическим проводником и солевым мостиком.
При схематическом изображении гальванического элемента граница раздела межу металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов - двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
Zn + 2AgNO3 > Zn(NO3)2 + 2Ag,
изображается следующим образом:
Zn | Zn(NO3)2 || AgNO3 | Ag
или
Zn | Zn(2+) || Ag(+) | Ag.

Комплексные соединения: теория Вернера. Понятия: комплексное соединение, внутренняя и внешняя сферы, лиганд, комплексообразователь, координационное число. Дентатность лигандов. Двойные соли
Теория координационных соединений, предложенная А. Вернером координационных соединений (для комплексов определенного вида). Рассмотрим ее основные положения.
1. Большинство элементов проявляет два типа валентности – главную и побочную.
2. Атом элемента стремится насытить не только главные, но и побочные валентности.
3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства.
В современной химии синонимом главной валентности является степень окисления элемента, а побочная валентность определяется как координационное число, то есть количество атомов непосредственно связанных с металлом при насыщении его побочной валентности.
В последнем соединении все три хлора участвуют не только в насыщении главной, но и побочных валентностей. В связи с этим в нем нет «подвижных» ионов хлора и он не способен на ионные реакции и не проводит электрический ток.
Главная валентность обусловлена, как уже упоминалось, степенью окисления кобальта (+3), то есть электростатическим притяжением трех однозарядных ионов хлора и одного трехзарядного иона кобальта. Побочная же валентность обусловлена так называемым явлением координации, которое, с современных позиций, может иметь различную природу. Те ионы, атомы, молекулы, которые координируются ионом металла называют лигандами; вместе с ионом металла они образуют так называемую внутреннюю координационную сферу. Не трудно заметить, что, несмотря на различие в строении комплексов, количество лигандов в каждом случае равно шести, однако в первом из соединений ни один из ионов хлора не является лигандом, так как не входит во внутреннюю координационную сферу, а образует так называемую внешнюю сферу противоионов, которая для последнего из соединений в ряду полностью отсутствует.
Ионы, не входящие во внутреннюю координационную сферу, при растворении комплекса обуславливают его электропроводность. В соответствии с этим диссоциацию комплексов можно записать так:
[Co(NH3)6]Cl3 ↔ [Co(NH3)6]3+ + 3Cl-
[Co(NH3)5Cl]Cl2 ↔ [Co(NH3)5Cl]2+ + 2Cl-
[Co(NH3)4Cl2]Cl ↔ [Co(NH3)4Cl2]+ + Cl-
[Ir(NH3)3Cl3] – не диссоциирует
Таким образом, первые два тезиса теории Вернера закрывают вопросы 1 – 3. Остановимся подробнее на третьем тезисе теории Вернера, а именно на том, что побочные валентности фиксированы в пространстве и определяют геометрию комплекса и его стереохимию.
При координационном числе 6, возможны три способа расположения шести точек в пространстве, относительно центра координации – то есть атома металла. Это правильный шестиугольник, правильный (или искаженный) октаэдр и центрированная правильная трехгранная призма.
Во времена Вернера рентгено-струкутрный анализ еще не был разработан, как метод определения пространственной структуры соединений, поэтому был использован следующий «остроумный» способ определения геометрии комплексов. Он состоял в сравнении количества реально существующих изомеров комплекса (полученных при всевозможных вариациях условий синтеза) с теоретически найденным числом изомеров, возможных только исходя из предполагаемой геометрической модели. При этом варьировалось также количество различных по типу лигандов, которые мы назовем X и Y.
Комплексное соединение – химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия " комплексная частица" нет. Обычно используется следующее определение.
Комплексная частица – сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию.
Например, гидратированный ион меди [Cu(H2O)4]2+ – комплексная частица, так как она реально существует в растворах и некоторых кристаллогидратах, образована из ионов Cu2+ и молекул H2O, молекулы воды – реально существующие молекулы, а ионы Cu2+ существуют в кристаллах многих соединений меди. Напротив, ион SO42- не является комплексной частицей, так как, хоть ионы O2- в кристаллах встречаются, ион S6+ в химических системах не существует.
Примеры других комплексных частиц: [Zn(OH)4]2-, [Al(H2O)6]3+, [Cu(H2O)2Br2], [HgI4]2-.
Вместе с тем к комплексным частицам относят ионы NH4+ и H3O+, хотя ионы H+ в химических системах не существуют.
Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. В большинстве комплексных частиц так и есть, но, например, в алюмокалиевых квасцах [K(H2O)6][Al(H2O)6]SO4 в комплексной частице [Al(H2O)6]3+ связь между атомами Al и O действительно образована по донорно-акцепторному механизму, а в комплексной частице [K(H2O)6]+ имеется лишь электростатическое (ион-дипольное) взаимодействие. Подтверждение этого – существование в железоаммонийных квасцах аналогичной по строению комплексной частицы [NH4(H2O)6]+, в которой между молекулами воды и ионом NH4+ возможно только ион-дипольное взаимодействие.
По заряду комплексные частицы могут быть катионами, анионами, а также нейтральными молекулами. Комплексные соединения, включающие такие частицы, могут относиться к различным классам химических веществ (кислотам, основаниям, солям). Примеры: (H3O)[AuCl4] – кислота, [Ag(NH3)2]OH – основание, NH4Cl и K3[Fe(CN)6] – соли.
Комплексообразователь – центральный атом комплексной частицы.
Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; при образовании комплексного соединения из более простых веществ она не меняется.
Лиганды – атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя.
Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH, Cl, PO43 и др.), а также катион водорода. Различают унидентатные или монодентатные лиганды (связанные с центральным атомом через один из своих атомов, то есть, одной -связью), бидентатные(связанные с центральным атомом через два своих атома, то есть, двумя связями), тридентатные и т. д.
Координационное число (КЧ) – число связей, образуемых центральным атомом с лигандами.
Если лиганды унидентатные, то координационное число равно числу таких лигандов.
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Существуют комплексные частицы и с несколькими центральными атомами.
Внутренняя сфера комплексного соединения – центральный атом со связанными с ним лигандами, то есть, собственно комплексная частица.
Внешняя сфера комплексного соединения – остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Наиболее часто встречаются комплексы с координационными числами 4 и 6. Расположение лигандов в таких комплексах квадратно-плоскостное (КЧ = 4), тетраэдрическое (КЧ = 4) и октаэдрическое (КЧ = 6) соответственно
Существуют лиганды, которые занимают не оно, а два и более координационных мест. Число связей, образуемых лигандом с комплексообразователем называют координационной емкостью или дентатностью лиганда. Монодентатные лиганды образуют только одну связь с комплексообразователем и занимают одно координационное место (H2O, OH–, NH3, CN–, Cl– и т.д.). Бидентатные лиганды образуют две связи с комплексообразователем и занимают два координационных места (например, диметилглиоксим). Существуют тридентатные, тетрадентатные и т.д. лиганды.Заряды комплексных ионов равны алгебраической сумме зарядов комплексообразователя и лигандов. Заряд [Fe(CN)6]4– определяется по сумме зарядов ионов: (2+) + (6–) = 4–.
Если в молекуле в качестве лиганда имеются нейтральные молекулы, их присутствие не отражается на заряде комплекса. Например, заряд иона [Cu(NH3)4]2+ является равным заряду Сu2+иона, т. е. комплексообразователя.
Заряд комплекса можно также определить по составу внешней сферы, после чего, найдя заряд комплексного иона, легко определить степень окисления комплексообразователя. Например, в соединении K4[Fe(CN)6] заряд внешней сферы равен 4+, следовательно, внутренняя сфера имеет заряд 4–.Соединение в целом электронейтрально. Заряд иона CN– равен –1, во внутренней сфере имеется 6 ионов CN–, следовательно комплексообразователь должен иметь заряд, равный 2+.
Используются два вида структурных формул комплексных частиц: с указанием формального заряда центрального атома и лигандов, или с указанием формального заряда всей комплексной частицы.
Для характеристики формы комплексной частицы используется представление о координационном полиэдре (многограннике).
Координационный полиэдр – воображаемый многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах – атомы лигандов, непосредственно связанные с комплексообразователем.
К координационным полиэдрам относят также квадрат (КЧ = 4), треугольник (КЧ = 3) и гантель (КЧ = 2), хотя эти фигуры и не являются многогранниками.
Дентатность лигандов
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH, тиоцианат-иона NCS, амид-иона NH2, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными.
Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и т.п. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения:

Двойные соли
Двойными солями называются комплексные соединения с неустойчивой внутренней сферой. К ним относятся в основном комплексные соединения амфотерных элементов. В отличие от обычных комплексных соединений двойные соли в водных растворах дисоциируют нацело. Наряду с незначительной концентрацией комплексного иона в растворе содержатся все продукты его полной диссоциации.
K2SO4 Al2(SO4)3
K[AL2(SO4)3]=  +
+  +SO
+SO  дисульфаталлюминат калия
дисульфаталлюминат калия

 =Al(OH)3
=Al(OH)3
SO  +
+ 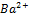 =BaSO4 доказательство
=BaSO4 доказательство
3  +[Co(NO2)6]
+[Co(NO2)6]  =K3[Co(NO2)6]
=K3[Co(NO2)6]
[Fe(CN)6]  +OH
+OH 
Аналитически в растворе КС практически не содержатся продукты диссоциации коплекс-иона и аналитически обнаружить ионы Fe3+ и CN3- невозможно, а в растворе ДС обнаружены как внутренние, так и внешние сферы с помощью качественных реакций.
 2020-08-05
2020-08-05 298
298








