В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения - это его распад на комплексный ион, образованный внутренней сферой и ионы внешней сферы. В водных растворах первичная диссоциация комплексных соединений обусловлена разрывом ионной связи между внутренней и внешней сферами, она практически необратима:
K3[Fe(CN)6] 3K(+) + [Fe(CN)6](3–)
Na[Al(OH)4] Na(+) + [Al(OH)4](–)
[Cu(NH3)4]SO4 [Cu(NH3)4](2+) + SO4(2–)
[Pt(NH3)4Cl2]Cl2 [Pt(NH3)4Cl2](2+) + 2Cl(–)
Образующийся комплексный ион ведет себя как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. В растворе красной кровяной соли нельзя обнаружить присутствие ионов Fe(3+) и CN(–), а в 1М растворе хлорида дихлоротетраамминплатины(IV) [Pt(NH3)4Cl2]Cl2 обнаруживается только присутствие 2 моль хлорид-ионов, а не 4 моль.
Но насколько устойчива внутренняя сфера комплекса? Может ли происходить отщепление лигандов от комплексообразователя? Действительно, это возможный процесс, он называется вторичной диссоциацией комплексного соединения.
Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.
Так как при этом разрушаются не ионные, а ковалентные связи комплексообразователя с лигандами, этот процесс затруднен и обратим. Он происходит ступенчато:
[Ag(NH3)2](+)? [Ag(NH3)](+) + NH3 1-ая ступень
[Ag(NH3)](+)? Ag(+) + NH3 2-ая ступень
Вторичная диссоциация характеризуется константой равновесия, причем для каждой из стадий можно вычислить свою константу. Для количественной оценки устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию. Эту константу называют константой нестойкости комплекса Кнест. В соответствии с законом действующих масс для приведенного нами выше примера диссоциации иона диамминсеребра выражение для константы нестойкости принимает вид:
Чем ниже Kнест, тем прочнее и стабильнее внутренняя сфера комплексного соединения, тем в меньшей мере происходит вторичная диссоциация комплексного соединения в растворе.
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере

Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости
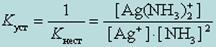
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса.
Способы разрушения комплексных соединений:
1. Нагревание:
[Ag(NH3)2]NO3 2 NH3↑ + Ag NO3
2. Образование более прочного комплекса:
[Ag(NH3)2]NO3 + 2NaCN = Na[Ag(CN)2] + NaNO3 + 2NH3
Кн = 6,810–8Кн = 110–21
3. Окислительно-восстановительные процессы:
Окисление
2K2[Ni(CN)4] + Br2 + 6KOH = 2Ni(OH)3 + 8KCN + 2KBr
Ni(+2) – 1ē = Ni(+3)
Восстановление
Zn + 2K[Au(CN)2] = 2Au + K2[Zn(CN)4]
(Au(+1)+ 1ē = Au
4. Связывание комплексообразователя:
[Ag(NH3)2]NO3 + KI = AgI↓ + 2 NH3↑ + KNO3
Связывание лигандов:
Na[Al(OH)4] + 4HCl = 4H2O + NaCl + AlCl3
 2020-08-05
2020-08-05 2471
2471
