Определение показателя адиабаты для воздуха
Цель работы: определить отношение теплоемкости воздуха при постоянном давлении к теплоемкости воздуха при постоянном объёме. Изучить термодинамические процессы в газах.
ВВЕДЕНИЕ
Теплоёмкостью С вещества называется величина, численно равная отношение количества теплоты δQ, сообщаемого веществу, к изменению его температуры dT в рассматриваемом термодинамическом процессе:
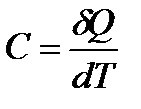 . (1)
. (1)
Величина С зависит от массы тела, его химического состава и процесса, в котором сообщается δQ.
Удельной теплоёмкостью называется теплоемкость единицы массы вещества:
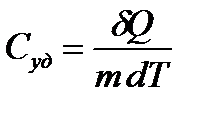 , (2)
, (2)
где т - масса вещества.
Молярной теплоёмкостью 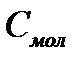 называется теплоёмкость одного моля вещества:
называется теплоёмкость одного моля вещества:
 , (3)
, (3)
где ν - количество вещества или число молей, которое равно отношению массы вещества к его молярной массе: 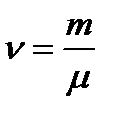 , μ – молярная масса.
, μ – молярная масса.
Различают теплоемкости при постоянном объёме 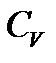 , если в термодинамическом процессе поддерживается постоянным объём вещества и при постоянном давлении
, если в термодинамическом процессе поддерживается постоянным объём вещества и при постоянном давлении 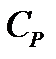 , если постоянно давление.
, если постоянно давление.
Если нагревать вещество при постоянном объёме, то все количество теплоты, сообщаемое веществу, полностью идет на увеличение его внутренней энергии. Если нагревать вещество при постоянном давлении, то количество теплоты, сообщаемое веществу, идет на увеличение его внутренней энергии и на работу изобарного расширения, поэтому 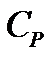 больше, чем
больше, чем 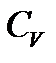 . Молярные теплоемкости при постоянном давлении
. Молярные теплоемкости при постоянном давлении 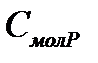 и постоянном объеме
и постоянном объеме 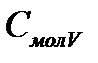 связаны между собой уравнением Майера:
связаны между собой уравнением Майера:
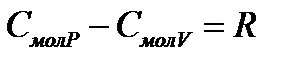 , (4)
, (4)
где R – универсальная газовая постоянная.
Физический смысл уравнения Майера заключается в том, что при изобарном нагревании газа к нему должна быть подведена большая теплота, чем для такого же изохорного нагревания. Эта разница в теплоте должна быть равна работе, совершаемой газом при изобарном расширении.
I закон или начало термодинамики. Теплота, сообщаемая системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил:
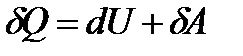 , (5)
, (5)
где 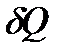 - малая теплота;
- малая теплота;
 - малое изменение внутренней энергии;
- малое изменение внутренней энергии;
 - элементарная (малая) работа.
- элементарная (малая) работа.
Внутренняя энергия 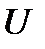 является однозначной функцией состояния системы, потому выражение
является однозначной функцией состояния системы, потому выражение  представляет собой полный дифференциал.
представляет собой полный дифференциал.
Ни теплота 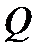 , ни работа
, ни работа  не являются функциями состояния и поэтому
не являются функциями состояния и поэтому 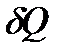 и
и  не являются полными дифференциалами.
не являются полными дифференциалами.
Понятия теплоты и работы имеют смысл только в связи с процессом изменения состояния системы.
Состояние идеального газа описывается уравнением Менделеева-Клапейрона:
 . (6)
. (6)
Если масса m и молярная масса µ постоянны, то для идеального газа для изопроцессов выполняются следующие законы.
1. Изохорный процесс:  - закон Шарля.
- закон Шарля.
2. Изобарный процесс: 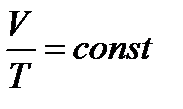 - закон Гей-Люссака.
- закон Гей-Люссака.
3. Изотермический процесс: 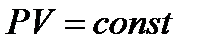 - закон Бойля-Мариотта.
- закон Бойля-Мариотта.
4. Адиабатный (изоэнтропийный) процесс: 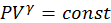 - закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме:
- закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме:
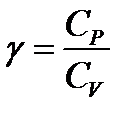 . (7)
. (7)
Заметим, что 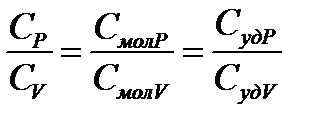 .
.
Для идеального газа изменение внутренней энергии при любом изопроцессе равно:
 . (8)
. (8)
С другой стороны:
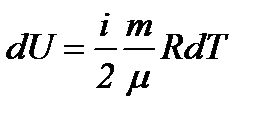 . (9)
. (9)
где 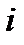 - число степеней свободы.
- число степеней свободы.
Числом степеней свободы тела называется наименьшее число координат (число независимых координат), которое необходимо задать для того, чтобы полностью определить положение тела в пространстве.
Приравняем правые части выражений (8) и (9), получим:
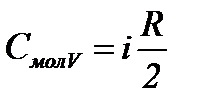 . (10)
. (10)
С учетом уравнения Майера (4) имеем:
 . (11)
. (11)
Тогда показатель адиабаты или коэффициент Пуассона равен:
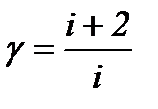 . (12)
. (12)
ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ И
МЕТОДА ИЗМЕРЕНИЙ
Определение показателя адиабаты 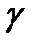 в настоящей работе производится следующим методом: исследуемый газ (воздух) заданной массы последовательно проходит через три различных состояния (рис. 1).
в настоящей работе производится следующим методом: исследуемый газ (воздух) заданной массы последовательно проходит через три различных состояния (рис. 1).
Установка состоит из баллона Б, в который можно накачивать воздух насосом Н. Для сообщения баллона с атмосферой служит кран К. Для проведения измерений служит измерительный блок ИБ, соединенный с компьютером ПК.
Из состояния 1 в состояние 2 газ переходит путем адиабатного расширения, из 2 в 3 – путем изохорного нагревания. Процесс 3 - 1 является изотермическим. Схема установки для определения величины 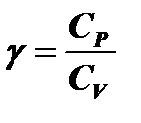 изображена на рис. 2. Внешний вид установки – на рис.3.
изображена на рис. 2. Внешний вид установки – на рис.3.
| Б |
| Н |
| ИБ |
| К ПК |
| Р Р1 Р3 Р2 |
| 0 V1 V2 V |
| 1 |
| 3 |
| 2 |
Рис. 1. График процессов Рис. 2. Схема установки

Рис.3. Внешний вид установки
Покажем, как опытным путем можно найти показатель адиабаты g. Пусть в баллоне объёмом V1 находится при комнатной температуре сжатый воздух, его давление  . На рис.1 этому состоянию соответствует точка 1. Если соединить баллон с атмосферой (открыть кран К), то воздух адиабатно расширяется и его температура уменьшается (процесс 1-2). Когда давление в баллоне станет
. На рис.1 этому состоянию соответствует точка 1. Если соединить баллон с атмосферой (открыть кран К), то воздух адиабатно расширяется и его температура уменьшается (процесс 1-2). Когда давление в баллоне станет  (давление не уменьшать до 0), надо закрыть кран К. После этого оставшийся воздух в баллоне станет изохорно нагреваться до комнатной температуры, при этом давление увеличивается до Р3 (см. рис.1). Точки 1 и 3 соответствуют комнатной температуре, т.е. процесс 1-3, изображенный на рис.1, изотермический, запишем для него закон Бойля - Мариотта:
(давление не уменьшать до 0), надо закрыть кран К. После этого оставшийся воздух в баллоне станет изохорно нагреваться до комнатной температуры, при этом давление увеличивается до Р3 (см. рис.1). Точки 1 и 3 соответствуют комнатной температуре, т.е. процесс 1-3, изображенный на рис.1, изотермический, запишем для него закон Бойля - Мариотта:
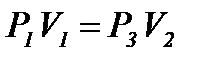 . (13)
. (13)
Процесс 1-2 адиабатный. Уравнение Пуассона или уравнение адиабаты:
 . (14)
. (14)
Из уравнений (13) и (14) определим g. Возведем уравнение (13) в степень g и разделим его на (14), тогда получим:
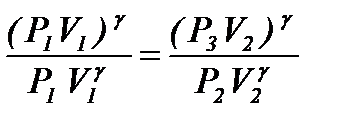 или
или  . (15)
. (15)
Прологарифмируем (15) и получим выражение для показателя адиабаты:
 . (16)
. (16)
 2020-08-05
2020-08-05 80
80







