Уровень задания: ВЫСОКИЙ
Количество баллов 3
Время на выполнение по тарификации экзамена 10-15 минут
КЭС (контролируемые элементы содержания):
4.3.7. Установление молекулярной и структурной формул вещества
КТ (контролируемые требования к освоению элементов содержания)
2.5.2 проводить вычисления по химическим формулам и уравнениям
ПРИМЕРЫ ЗАДАЧ ДЕМОВЕРСИИ И ДОСРОЧНОГО ЕГЭ 2020
При сгорании 40,95 г органического вещества получили 39,2 л углекислого газа (н.у.), 3,92 л азота (н.у.) и 34,65 г воды. При нагревании с соляной кислотой данное вещество подвергается гидролизу, продуктами которого являются соединение состава С2H6NО2Cl и вторичный спирт. На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза вещества в присутствии соляной кислоты (используйте структурные формулы органических веществ).
КРИТЕРИИ ответа:
Проведены вычисления, и найдена молекулярная формула исходного органического вещества:
Если образовался свободный азот, значит сгорело азотосодержащее или кислородазотосодержащее органическое вещество
1. Находим количество вещества азота, воды и углекислого газа, исходя из данных задачи
n(CO2) = 39,2л: 22,4л/моль = 1,75 моль; n(С) = 1,75 моль
n(H2O) = 34,65г: 18г/моль = 1,925 моль; n(H) = 1,925моль · 2 = 3,85 моль
n(N2) = 3,92л: 22,4л/моль = 0,175 моль; n(N) = 0,175моль · 2 = 0,35 моль
2. Находим массы С, О и N в порции сгоревшего вещества
m(C + H + N) = 1,75моль · 12г/моль + 3,85моль · 1г/моль + 0,35моль · 14г/моль = 29,75 г
3. В условии сказано, что порция вещества весит 40,95 г, это означает, что разница в массе – это масса кислорода
m(О) = 40,95г – 29,75г = 11,2 г
n(O) = 11,2г: 16г/моль = 0,7 моль
4.Находим мольные отношения элементов в составе молекулы
n(С): n(Н): n(N): n(O) = 1,75: 3,85: 0,35: 0,7 = 5: 11: 1: 2
Молекулярная формула – C5H11NO2 – это сложный эфир изопропилового спирта и аминоуксусной кислоты – изопропиламиноацетат.
Такой же формуле соответствует 2-амино-3-метилбутановая кислота (валин) и др.
Но по условию вещество должно вступать в гидролиз и должен получиться вторичный спирт. Значит это сложный эфир
Составлена структурная формула вещества:
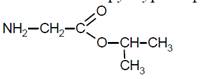
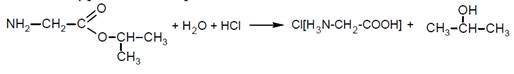
5. По условию задачи понятно, что образуется хлорид аминоуксусной кислоты (в этой реакции кислота ведёт себя как основание, реакция присоединения иона водорода по аминогруппе). Значит, эфир подвергается гидролизу в присутствии соляной кислоты.
Реакция идёт в две стадии: водный гидролиз эфира с образованием пропанола-2 и аминоуксусной кислоты. Затем аминоуксусная кислота реагирует с соляной.
Окончательное уравнение реакции
КРИТЕРИИ ОЦЕНИВАНИЯ
Ответ правильный и полный, содержит следующие элементы:
• правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества;
• записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания;
• с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания 3
Правильно записаны два элемента ответа 2
Правильно записан один элемент ответа 1
Все элементы ответа записаны неверно 0
Максимальный балл 3
При сгорании органического вещества А массой 4,0 г получено 4,48 л (н.у.) углекислого газа и 2,88 г воды. Известно, что вещество А вступает в реакцию с раствором гидроксида бария при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит три атома углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с раствором гидроксида бария при нагревании (используйте структурные формулы органических веществ).
РЕШЕНИЕ:
Проведены необходимые вычисления, и найдена молекулярная формула вещества А:
1. Находим количество вещества углерода и водорода через воду и углекислый гпз
n(CO2) = 4,48л: 22,4л/моль = 0,2 моль; n(С) = 0,2 моль
n(H2O) = 2,88г: 18г/моль = 0,16 моль; n(H) = 0,16моль・2 = 0,32 моль
2. Находим массу углерода и водорода в искомой порции вещества
m(C + H) = 0,2моль・12г/моль + 0,32моль・1г/моль = 2,7 г
При сравнении найденной массы видим, что в состав вещества входит кислород
3. Находим массу кислорода (от массы порции вещества вычесть массу углерода и водорода)
m(О) = 4,0г – 2,72г = 1,28 г
4. Находим количество вещества кислорода в порции
n(O) = 1,28г:16г/моль = 0,08 моль
5. Находим мольные отношения и по ней формулу вещества
n(С): n(Н): n(O) = 0,2: 0,32: 0,08 = 5: 8: 2
Молекулярная формула – C5H8O2
Данной формуле соответствует либо непредельная одноосновная карбоновая кислота, либо сложный эфир, в котором есть одна двойная связь. По условию задачи вещество вступает в реакцию с раствором гидроксида бария при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит три атома углерода.
Значит это этиловый эфир акриловой кислоты, который подвергается щелочному гидролизу.

При сгорании органического вещества А массой 3,4 г получено 4,48 л (н.у.) углекислого газа и 1,8 г воды. Известно, что вещество А вступает в реакцию с раствором гидроксида лития при нагревании, в результате чего образуется предельный одноатомный спирт и соль, кислотный остаток которой содержит семь атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с раствором гидроксида лития при нагревании (используйте структурные формулы органических веществ).
РЕШЕНИЕ:
1. Находим количество вещества всех элементов, проверяем наличие в составе вещества кислорода
n(CO2) = 4,48л: 22,4л/моль = 0,2 моль; n(С) = 0,2 моль
n(H2O) = 1,8г: 18г/моль = 0,1 моль; n(H) = 0,1моль ・ 2 = 0,2 моль
m(C + H) = 0,2моль・12г/моль + 0,2моль・1г/моль = 2,6 г
m(О) = 3,4г – 2,6г = 0,8 г
n(O) = 0,8г: 16г/моль = 0,05 моль
2. Находим мольные отношения и формулу вещества
n(С): n(Н): n(O) = 0,2: 0,2: 0,05 = 4: 4: 1
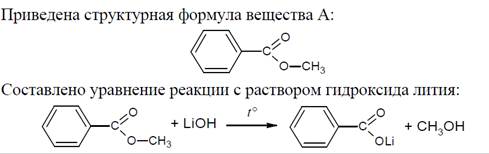
Молекулярная формула – C8H8O2
Судя по соотношению числа атомов углерода и водорода, вещество содержит бензольное кольцо. А судя по продуктам реакции – это щелочной гидролиз эфира, образованного ароматической кислотой. То есть это метиловый эфир бензойной кислоты.
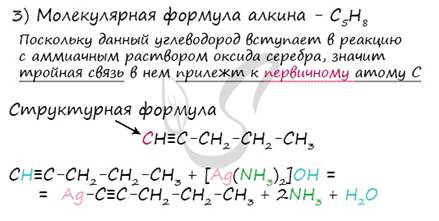
Определите массу неизвестного углеводорода ацетиленового ряда, если молярная масса продукта его реакции с избытком хлороводорода в 2.07 раза больше, чем молярная масса исходного углеводорода.
Известно, что данный ацетиленовый углеводород вступает в реакцию с аммиачным раствором оксида серебра.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле
3) напишите уравнение реакции для данного углеводорода с аммиачным раствором оксида серебра.
РЕШЕНИЕ
1) Запишем реакцию ацетиленового углеводорода с хлороводородом, использовав общую формулу ацетиленовых углеводородов (CnH2n-2). Сравним количество вещества алкина и хлорзамещенного продукта реакции.
2) Через общую формулу алкина выразим его молярную массу, таким же образом поступим с хлорзамещенным продуктом реакции. Их молярные будут различаться в 2 раза (исходя из условий задачи), отразим это в виде дроби и решим ее, найдя неизвестное "n". 3) Установим молекулярную и структурную формулы алкина, запишем реакцию с аммиачным раствором оксида серебра.

ЗАДАЧИ ДЛЯ ТРЕНИРОВКИ
https://studarium.ru/working/3/35/page-1
https://yandex.ru/tutor/subject/tag/problems/?ege_number_id=376&tag_id=19
http://www.yoursystemeducation.com/realnyj-ege-po-ximii-2019-zadanie-35/
 2020-08-05
2020-08-05 204
204






