Теоретическая часть.
I. Сущность метода
Фотоколориметрический анализ основан на законе светопоглощения света видимой области исследуемым веществом. Для монохроматического электромагнитного излучения закон светопоглощения (закон Бугера – Ламберта – Бера) имеет вид:
А = -lg(I/I0) = -lgT = ε∙ ℓ∙ C (1)
I – интенсивность прошедшего излучения;
I0 –интенсивность падающего излучения;
ℓ – толщина светопоглощающего слоя;
А – оптическая плотность вещества;
Т – коэффициент (степень) светопропускания;
ε – молярный коэффициент светопоглощения;
C – концентрация оптически активного вещества.
Поглощение света зависит от длины волны излучения. Эта зависимость называется спектром поглощения.
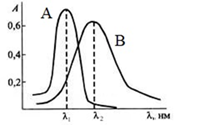
Рис. 1. Спектры поглощения: А – хром (6+); В – хром (3+)
Основным методом фотоколориметрии является графический метод или метод градуировочной кривой. Сущность метода заключается в построении зависимости оптической плотности А от концентрации вещества С для серии стандартных растворов. Далее оптическая плотность исследуемого раствора сравнивается с этой зависимостью и находится соответствующая концентрация вещества.
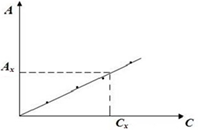
Рис. 2. Зависимость оптической плотности от концентрации
В ряде случаев может наблюдаться отклонение от закона светопоглощения. Оно может быть вызвано физическими и химическими причинами. Основной физической причиной является немонохроматичность излучения, измерение оптических плотностей проводят при длинах волн, соответствующих пологим участкам спектра. Измерение при максимальных значениях оптических плотностей важно потому, что при этом определение происходит с наибольшей чувствительностью. Погрешность в измерении оптической плотности приемлема в интервале оптических плотностей от 0,15 до 1,2. Погрешность минимальна при значении оптической плотности 0,4. Химической причиной является несоответствие заявленного и действительного химического состава исследуемого раствора. Например, в растворе хрома (6+) имеет место равновесие:
2CrO42- + 2H+ = Cr2O72- + H2O
Спектры поглощения хромата и бихромата сильно различаются, поэтому будет наблюдаться отклонение от линейной зависимости, если вы измеряете оптическую плотность раствора бихромата. Однако можно подкислить раствор и поддерживать кислотность на одном уровне, чтобы соотношение хромат-бихромат оставалось постоянным. При этом оптическая плотность раствора будет изменяться пропорционально общей концентрации хрома (6+). Здесь проявляется важная закономерность оптических плотностей – принцип аддитивности:
Aобщ. = ℓ∙∑(εi∙Ci) (2)
Иначе говоря, оптическая плотность раствора смеси окрашенных веществ равна сумме оптических плотностей каждого вещества.
На практике придерживаются следующего алгоритма работы:
1. Изучение спектра поглощения каждого вещества и выбор светофильтров.
2. Измерение оптических плотностей стандартных растворов каждого вещества при выбранных светофильтрах.
3. Построение градировочных графиков.
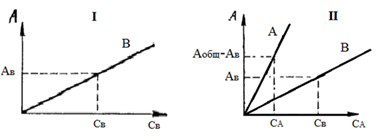
По сути, анализ смеси двух окрашенных соединений вещества А и В (в нашем случае А – это хром (6+), а В – хром (3+)) сводится к решению системы двух уравнений типа (2) для двух длин волн 1 и 2:
A1 oбщ = ℓ∙ [ελ1(A) ∙ C(A) + ελ1(B) ∙ C(B)]
A2 oбщ = ℓ∙ [ελ2(A) ∙ C(A) + ελ2(B) ∙ C(B)] (3)
Если известны молярные коэффициенты поглощения, а общие оптические плотности найдены экспериментально, то остается только рассчитать концентрации веществ в смеси. Значения молярных коэффициентов поглощения находят по градуировочным графикам как тангенсы углов наклона соответствующих прямых. Задача сильно упрощается, если при одной из длин волн одно из веществ не поглощает излучение.
 2020-08-05
2020-08-05 5005
5005