Реактивы и оборудование.
2.1. Тиосульфат натрия (сухой)
2.2. Бихромат калия (сухой)
2.3. Кальцинированная сода Na2CO3 (сухая)
2.4. Дистиллированная вода
2.5. Раствор 10% KI (в автопипетке)
2.6. Раствор 2н серной кислоты (в автопипетке)
2.7. Свежекипяченая вода
2.8. Свежеприготовленный раствор крахмала (0,5 г крахмала растворить в небольшом количестве холодной воды и влить в 100 мл кипящей воды. Размешать и кипятить 1-2 мин)
2.9. Промывалка
2.10.Хромовая смесь
2.11.Бюретка на 50 мл
2.12.Пипетки Мора на 25 мл, 10 мл
2.13.Цилиндр на 200 мл
2.14.Мерная колба на 250 мл
2.15.Коническая колба на 250 мл со стеклом
2.16.Бюкс
2.17.Весы аналитические
2.18.Воронки
Ход работы.
3.1. Приготовление раствора тиосульфата натрия приблизительной нормальности.
В связи с высокой чувствительностью йод-крахмальной реакции, удобнее работать при этом методе 0,02 н растворами. Тиосульфат натрия представляет собой кристаллогидрат г-экв Na2S2O3 5H2O = M/2 = 248,2/2=124,1 г. Требованиям исходных веществ не отвечает, взаимодействует с углекислотой в растворе и разлагается микроорганизмами.
Na2S2O3 + H2CO3 = NaHSO3 + NaHCO3 + S
Поэтому его раствор готовят сначала приблизительной нормальности и устанавливают по какому-либо исходному веществу, например: K2Cr2O7, KMnO4, I2.
На 300 мл необходимо взвесить: 124,1 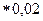 *0,3=0,75 г Na2S2O3.Взвесить на технических весах 0,75 г Na2S2O3. Для получения более устойчивого титра растворить в свежекипяченной воде, довести объем раствора до литра, перемешать, плотно закрыть и поставить в темное место на сутки.
*0,3=0,75 г Na2S2O3.Взвесить на технических весах 0,75 г Na2S2O3. Для получения более устойчивого титра растворить в свежекипяченной воде, довести объем раствора до литра, перемешать, плотно закрыть и поставить в темное место на сутки.
3.2. Определение нормальности тиосульфата натрия по перманганату калия.
Нормальность KMnO4 устанавливается в методе перманганатометрии по оксалату натрия.
В колбу Эрлеймейера прилить 10 мл 10 % йодида калия из автопипеки 10 мл 2 н H2SO4 из автопипетки и 10 мл KMnO4 пипеткой Мора. При этом выделяется йод
10 I- + 2 MnO4- +16 H+ = 5 I2 +2 Mn 2+ + 8 H2O
Закрыть колбу стеклом, поставить в шкаф на 5 мин. Разбавить смесь 100 мл H2O и медленно при перемешивании приливать из бюретки раствор Na2S2O3 до перехода от темно-бурого окрашивания до соломенно-желтого. Прилить 3 мл крахмала и титровать раствором тиосульфата натрия. Когда окраска станет чистой синей прибавляют раствор Na2S2O3 особенно осторожно, взбалтывая содержимое колбы после каждой прилитой капли, до перехода окраски от синей до бесцветной от одной капли раствора тиосульфата натрия.
 |
KI+ KMnO4+H2SO4 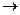 I2 + MnSO4 + K2 SO4 + H2O
I2 + MnSO4 + K2 SO4 + H2O
I2 + Na2S2O3 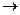 Na2S4O6 + NaI
Na2S4O6 + NaI
Титрование повторяют 3-4 раза, до сходящихся результатов.
Данные записывают в таблицу.
3.3.Вычисление:
N (Na2S2O3) = [ N (KMnO4)* V (KMnO4) ] / V (Na2S2O3)
T(Na2S2O3) =N (Na2S2O3) 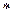 mэ(Na2S2O3) / 1000.
mэ(Na2S2O3) / 1000.
TKMnO 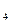
| VKMnO 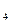
| NKMnO 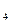
| VNa 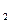 S S 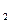 O O 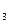
| NNa 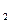 S S 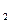 O O 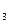
| TNa 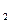 S S 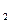 O O 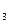
|
|
|
|
| |||
|
| |||||
Например: 10мл 0,05 Н KMnO4 пошло 10,66 мл Na2S2O3
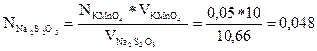 н
н
Расчеты:
Техника безопасности.
4.1. При работе соблюдать правила работы с солями, хромовой смесью, стеклянной посудой, весами HCB602H, HR-250AZG.
Контрольные вопросы.
5.1.Рабочие растворы и индикаторы метода иодометрии.
5.2.Основные уравнения реакций метода иодометрии.
5.3.Как определяется эквивалент окислителя и восстановителя.
5.4.Подобрать коэффициенты, указать окислитель, восстановитель, эквиваленты окислителя, восстановителя:
KI+ KMnO4+H2SO4 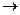 I2 + MnSO4 + K2 SO4 + H2O
I2 + MnSO4 + K2 SO4 + H2O
Контрольные ответы.
3.4 Расчеты
| Номер варианта | N KMnO4 н | V KMnO4 мл | V Na2S2O3 мл | N Na2S2O3 н | Титр Na2S2O3 г/мл |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 0 | 0,0200 | 10,00 | 10 | ||
| 1 | 9,9 | ||||
| 2 | 9,8 | ||||
| 3 | 9,7 | ||||
| 4 | 9,6 | ||||
| 5 | 9,5 | ||||
| 6 | 9,4 | ||||
| 7 | 9,3 | ||||
| 8 | 9,2 | ||||
| 9 | 9,1 | ||||
| 10 | 10,1 | ||||
| 11 | 10,2 | ||||
| 12 | 10,3 | ||||
| 13 | 10,4 | ||||
| 14 | 10,5 | ||||
| 15 | 10,6 | ||||
| 16 | 10,7 | ||||
| 17 | 10,8 | ||||
| 18 | 10,9 | ||||
| 19 | 9,6 | ||||
| 20 | 9,5 | ||||
| 21 | 9,4 | ||||
| 22 | 9,3 | ||||
| 23 | 9,2 | ||||
| 24 | 9,1 |
 2020-08-05
2020-08-05 100
100






