Физиология печени
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма белков, жиров и углеводов. К основным функциям печени относятся обмен белков, углеводов, липидов, ферментов, витаминов; водный и минеральный обмен, пигментный обмен, секреция желчи, детоксицирующая функция. Все обменные процессы в печени чрезвычайно энергоемки. Основными источниками энергии являются процессы аэробного окисления цикла Кребса и нуклеотиды, выделяющие значительное количество энергии в результате высвобождения фосфатидных связей при переходе аденозинтрифосфата в аденозиндифосфат.
Белковый обмен
Печень ответственна как за основные анаболические, так и за катаболические процессы обмена белков. Синтез белков в печени осуществляется из свободных аминокислот. Это прежде всего экзогенные аминокислоты, поступающие с кровью воротной вены из кишечника. Приток этих аминокислот в печень зависит от количественного и качественного состава пищи, активности пищеварительных ферментов, фазы пищеварения и т. д. Колебания поступления аминокислот в нормальных условиях соответствуют суточному циклу активности печеночных клеток.
Эндогенные свободные аминокислоты образуются в организме вследствие физиологического клеточного распада в других органах. Обычно приток указанных веществ в печень относительно постоянен. Небольшое количество аминокислот образуется в самой печени из углеводов и жирных кислот.
Печень является единственным местом синтеза альбуминов, фибриногена, протромбина, проконвертина, проакцелерина. Основная масса?-глобулинов, значительная часть?-глобулинов, гепарина, ферментов также образуется в печени. Синтез белков и многочисленных ферментов осуществляется в гепатоцитах рибосомами. Собственные белки и ферменты печеночных клеток синтезируются на свободных рибосомах и полисомах гиалоплазмы гепатоцитов, не связанных с мембранами эндоплазматического ретикулума. Синтез белков «на экспорт» осуществляется рибосомами зернистого эндоплазматического ретикулума.
Большинство заболеваний печени с тяжелыми повреждениями паренхимы сопровождается снижением уровня как альбуминов, так и α-глобулинов. Гипоальбуминемия - один из характерных признаков острой и хронической недостаточности печени.
Синтез гама гбулинов осуществояется главным образом плазматическими клетками. Купферовские клетки печени, как показали радиоизотопные исследования, также участвуют в их синтезе. Значительное повышение уровня?-глобулинов крови при заболеваниях печени с выраженной иммунной реакцией связано не только с общей реакцией ретикулоэндотелиальной ткани, но и с плазматической инфильтрацией.
Печень не только синтезирует такие важнейшие компоненты свертывающей системы крови, как протромбин, фактор VII, но и наряду с другими органами участвует в образовании гепарина. Вследствие этого система свертывания крови в значительной мере зависит от белковосинтетической функции печени и патологических изменений гепатоцитов.
В печени осуществляются все этапы расщепления белков до образования аммиака и мочевины. Протеолитические ферменты расщепляют тканевые и сывороточные белки до низкомолекулярных соединений. Ферменты дезаминирования, окисления, входящие в цикл Кребса, производят дальнейшее многоэтапное расщепление пептидных соединений и аминокислот. При значительных поражениях паренхимы, особенно при массивных некрозах, повышается уровень свободных аминокислот, остаточного азота в крови; при этом значительная часть свободных аминокислот выделяется с мочой. В печени из свободных аминокислот наряду с их разрушением с образованием мочевины и частичной реутилизацией, с новообразованием белков синтезируются жирные кислоты и кетоновые тела. Следовательно, фрагменты белкового обмена в печени включаются в обменные циклы других веществ.
Печень осуществляет катаболизм нуклеопротеидов с их расщеплением до аминокислот, пуриновых и пиримидиновых оснований. В печени последние превращаются в мочевую кислоту, выделяемую затем почками. Важно отметить, что конечные этапы катаболических изменений белковых тел в печени одновременно представляют ее детоксицирующую функцию.
Углеводный обмен
Печень играет центральную роль в многочисленных реакциях промежуточного обмена углеводов. Среди них особенно важны превращение галактозы в глюкозу; превращение Фруктозы в глюкозу; синтез и распад гликогена; глюконеогенез; окисление глюкозы; образование глюкуроновой кислоты.
Превращение галактозы в глюкозу. Галактоза поступает в организм в составе молочного сахара. В печени происходит ее превращение через уридиндифосфогалактозу в глюкозо-1-фосфат. При нарушении функции печени способность организма использовать галактозу снижается, на этом основана функциональная проба печени с нагрузкой галактозой.
Превращение фруктозы в глюкозу.
Синтез и распад гликогена. Гликоген синтезируется из активированной глюкозы, т. е. из Г-6-Ф. Печень может синтезировать гликоген и из других продуктов углеводного обмена, например из молочной кислоты. Распад гликогена в печени происходит и гидролитически, и (преимущественно) фосфоролитически. Под действием фосфорилазы образуется Г-1-Ф, который превращается в Г-6-Ф; последний включается в различные метаболические процессы. Печень служит единственным поставщиком глюкозы в кровь, так как только под влиянием печеночной микросомальной Г-6-фосфатазы из Г-6-Ф освобождается глюкоза. Таким образом, под влиянием обратимых реакций синтеза и распада гликогена регулируется количество глюкозы в соответствии с потребностями организма. Уровень гликогена регулируется гормональными факторами: АКТГ, глюкокортикоиды и инсулин повышают содержание гликогена в печени, а адреналин, глюкагон, соматотропный гормон и тироксин понижают.
Глюконеогенез. Глюкоза может синтезироваться из различных соединений неуглеводной природы, таких, как лактат, глицерин, некоторые метаболиты цитратного цикла и глюкопластические аминокислоты (глицин, аланин, серии, треонин, валин, аспарагиновая и глютаминовая кислоты, аргинин, гистидин, пролин и оксипролин). Глюконеогенез связывает между собой обмен белков и углеводов и обеспечивает жизнедеятельность при недостатке углеводов в пище.
Образование глюкуроновой кислоты. С обменом углеводов связан синтез глюкуроновой кислоты, необходимой для конъюгации плохо растворимых веществ (фенолы, билирубин и др.) и образования смешанных полисахаридов (гиалуроновая кислота, гепарин и др.).
В основе нарушений обмена углеводов при заболеваниях печени лежат повреждения митохондрий, которые ведут к снижению окислительного фосфорилирования. Вторично страдают функции печени, требующие расхода энергии - синтез белка, эстерификация стероидных гормонов. Дефицит углеводов приводит также к усилению анаэробного гликолиза, вследствие чего в клетках накапливаются кислые метаболиты, вызывающие снижение рН. Следствием этого является разрушение лизосомальных мембран и выход в цитоплазму кислых гидролаз, вызывающих некроз гепатоцитов.
Жировой обмен
Печень играет ведущую роль в обмене липидных веществ - нейтральных жиров, жирных кислот, фосфолипидов, холестерина. Участие печени в обмене липидов тесно связано с ее желчевыделительной функцией: желчь активно участвует в ассимиляции жиров в кишечнике. При нарушении образования или выделения желчи жиры в повышенном количестве выделяются с калом. Желчь усиливает действие панкреатической липазы и вместе с рядом других веществ участвует в образовании хиломикронов. Гепатоциты с помощью микроворсинок непосредственно захватывают липиды из крови. В печени осуществляются следующие процессы обмена липидов: окисление триглицеридов, образование ацетоновых тел, синтез триглицеридов и фосфолипидов, синтез липопротеидов, синтез холестерина.
Гидролиз триглицеридов на глицерин и жирные кислоты происходит под действием внутрипеченочных липолитических ферментов. Печень является центральным местом метаболизма жирных кислот. В ней происходит синтез жирных кислот и их расщепление до ацетилкофермента А, а также образование кетоновых тел, насыщение ненасыщенных жирных кислот и их включение в ресинтез нейтральных жиров и фосфолипидов с последующим выведением в кровь и желчь. Катаболизм жирных кислот осуществляется путем?-окисления, главной реакцией которого является активирование жирной кислоты с участием кофермента А и АТФ. Освобождающийся ацетилкофермент А подвергается полному окислению в митохондриях, в результате чего клетки обеспечиваются энергией. Следует отметить, что в печени образуется лишь 10% общего количества жирных кислот, основным местом их синтеза является жировая ткань. Кетоновые тела (ацетоуксусная, бета -оксимасляная кислоты и ацетон) образуются почти исключительно в печени. В норме их содержание в плазме не превышает 10 мг/л, а при сахарном диабете оно может увеличиться в сотни раз. Возникающий в патологических условиях кетоз связан с диссоциацией кетогенеза в печени и утилизацией кетоновых тел в других органах. Из жирных кислот, глицерина, фосфорной кислоты, холина и других оснований печень синтезирует важнейшие составные части клеточных мембран - различные фосфолипиды. Синтез нейтральных жиров и фосфолипидов связан главным образом с митохондриями, а также с гладким эндоплазматическим ретикулумом.
Синтез холестерина в основном происходит в печени и кишечнике, где образуется более 90% всего холестерина. Холестерин представляет собой важную составную часть плазмы крови и используется для синтеза кортикостероидных гормонов и витамина D. Основная масса холестерина синтезируется гладкой эндоплазматической сетью. Уровень холестерина поддерживается постоянным в результате синтеза, катаболизма и выведения избыточного количества с желчью в кишечник: пятая часть его выделяется с калом, а большая часть всасывается вновь, обеспечивая печеночно-кишечную циркуляцию. Печеночные клетки полностью ответственны за удаление избыточного количества холестерина из организма путем выведения как самого холестерина, так и его производных (желчные кислоты) с желчью. Нарушение печеночно-кишечной циркуляции вследствие окклюзии желчевыводящих путей приводит к резкому возрастанию синтеза желчных кислот из холестерина.
В печени происходит синтез липопротеидов, особой транспортной формы фосфолипидов, нейтральных жиров и холестерина. Предполагают, что фосфолипиды служат связующим звеном между белком и липидным компонентом. В зависимости от того, с какой фракцией сывороточных белков они передвигаются, при электрофорезе различают?-,?- и пре-?-липопротеиды. Пре-?-липопротеиды - главная транспортная форма эндогенных триглицеридов.
Пигментный обмен
Возникновение желтухи всегда обусловлено нарушением обмена билирубина, который образуется в результате распада гемоглобина эритроцитов и разрушения гема. Этот процесс является естественной составной частью постоянного обновления красной крови в организме.
Образование билирубина
Гемоглобин превращается в билирубин в ретикулоэндотелиальной системе, главным образом в печени, селезенке и костном мозге посредством сложного комплекса окислительно-восстановительных реакций. Конечным продуктом распада является биливердин, не содержащий железа и белковой части. Клетки ретикулоэндотелиальной системы выделяют в кровь непрямой, свободный билирубин. За сутки у человека распадается около 1% циркулирующих эритроцитов с образованием 100 - 250 мг билирубина, при этом 5 - 20% билирубина образуется из гемоглобина не зрелых, а преждевременно разрушенных эритроцитов и из других гемсодержащих веществ. Это так называемый шунтовои или ранний билирубин.
Исследованиями с введением в организм изотопных предшественников гема (15N- и 14С-глицин) установлено, что большинство образующихся меченых желчных пигментов выделяются с калом в виде уробилина или стеркобилина в период между 90-м и 150-м днем после введения изотопа, что соответствует продолжительности жизни эритроцитов [Gray С. Н., 1950, 1959; London J. М., 1950].
Выявлено незначительное содержание меченого пигмента в кале сразу же после применения изотопного предшественника, составляющее от 10 до 20% всей меченой пигментной экскреции, что соответствует раннему, или шунтовому, билирубину.
Значительное увеличение образования раннего билирубина обнаружено при болезнях, связанных с неэффективным эритропоэзом, таких, как железодефицитная анемия, пернициозная анемия, талассемия, сидеробластическая анемия, эритропоэтическая порфирия, свинцовое отравление. При этих состояниях количество раннего пигмента колеблется от 30 до 80% всех желчных пигментов. Больные с этой патологией имеют значительно увеличенную фекальную уробилиногенную экскрецию как следствие увеличенного тотального желчного пигментного оборота, но без укорочения жизни эритроцитов периферической крови.
Существование второго неэритроцитного компонента раннего билирубина доказано с применением меченой аминолевулиновой кислоты, являющейся маркером гема из других источников. Наиболее вероятным источником неэритроцитного гема служат печеночные протеиды: миоглобин, цитохромы, каталаза и триптофанпирролаза печени.
Экспериментально установлено, что печеночная часть раннего билирубина может увеличиваться после анестезии, применения фенобарбитала. Этим может объясняться повышение сывороточного билирубина, часто наблюдаемое непосредственно после операции [Israels L. G., 1970].
Обмен билирубина
Печень выполняет три важнейшие функции в обмене билирубина: захват билирубина из крови печеночной клеткой, связывание билирубина с глюкуроновой кислотой и выделение связанного билирубина из печеночной клетки в желчные капилляры. Перенос билирубина из плазмы в гепатоцит происходит в печеночных синусоидах.
Свободный (непрямой) билирубин отделяется от альбумина в цитоплазменной мембране, внутриклеточные протеины захватывают билирубин и, возможно, ускоряют перенос билирубина в гепатоцит (рис. 10). A. J. Levi и соавт. (1969) изолировали из цитоплазмы печени 2 неспецифических связывающих протеина, обозначенных как Y- и Z-протеины, которые, по мнению авторов, отвечают за большую часть внутриклеточного захвата билирубина. Протеин У присутствует в печени в относительно большом количестве и связывает также другие органические анионы, такие, как бромсульфалеин, метаболиты кортизона [Litmack G., 1971]. Предполагают, что печеночная мембрана активно участвует в захвате билирубина из плазмы. В подтверждение этого приводятся данные об угнетении рифампицином печеночного подъема билирубина раньше, чем включаются неспецифические связывающие протеины.
Непрямой билирубин в клетке переносится в мембраны эндоплазматической сети, где билирубин связывается с глюкуроновой кислотой. Эта реакция катализируется специфическим для билирубина ферментом УДФ-глюкуронилтрансферазой. Соединение билирубина с сильно поляризующей глюкуроновой кислотой делает его растворимым в воде, что и обеспечивает переход в желчь, фильтрацию в почках и быструю (прямую) реакцию с диазореактивом.
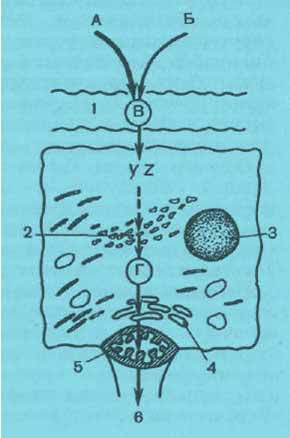
Рвс. 1. Схема транспорта билирубина в печеночной клетке (по L. Schiff).
А- разрушенные эритроциты; Б - ранний билирубин. В - свободный (непрямой) билирубин. 1 - синусоид; 2' - гладкий эндоплазматический ретикулум; 3 - ядро; 4 - аппарат Гольджи; 5 - желчный каналец; YZ - цитоплазматические протеины.
Образующийся пигмент называется связанным или прямым билирубином.
Новые микроаналитические методики, такие, как тонкослойная газовая хроматография и спектроскопия, позволили подтвердить первоначальную точку зрения о существовании 2 типов конъюгатов: диглюкуронида, в котором на 1 молекулу билирубина приходится 2 молекулы глюкуроновой кислоты (пигмент II), и моноглюкуронида, или соединения несвязанного билирубина и диглюкуронида (пигмент I). Многочисленными хроматографическими исследованиями показано существование конъюгатов билирубина с серной и фосфорной кислотами, но их физиологическое значение невелико.
Транспорт билирубина
Выделение билирубина в желчь представляет собой конечный этап обмена пигмента в печеночных клетках. В желчи обнаруживается лишь небольшое количество несвязанного билирубина, связывание требуется для экскреции пигмента печенью. О механизмах переноса билирубина из печени в желчь известно мало; определенную роль играет градиент концентрации. Некоторые вещества конкурируют с билирубином за путь выделения в желчь и могут вызвать желтуху. К ним относятся анаболические стероиды с С17-замещенным радикалом, рентгеноконтрастные препараты для холецистографии, бромсульфалеин. G. D. Raymond, J. Т. Galambos (1971) при исследовании максимальной экскреции билирубина у человека показали, что печень способна выделить пигмента в 10 раз больше, чем его образуется в физиологических условиях. Таким образом, у здорового человека есть большой функциональный резерв для экскреции билирубина. При ненарушенном связывании переход билирубина из печени в желчь зависит от скорости секреции желчи. Предполагают, что экскреция билирубина находится под гормональным контролем, так как скорость выделения связанного билирубина уменьшается у гипофизэктомированных животных и может быть нормализована гипофизарными гормонами или тироксином [Gartner L. M., Arias I. M., 1972]. Билирубин выделяется из печени в желчь с помощью цитоплазматических мембран билиар-ного полюса гепатоцита, лизосом и аппарата Гольджи.
 2020-08-05
2020-08-05 95
95







