1. При попадании на кожу концентрированных кислот следует немедленно промыть обожженное место сильной струей водопроводной воды, после чего наложить повязку из ваты или бинта, смоченную или раствором гидрокарбоната натрия, или раствором таннина. При попадании на кожу концентрированных щелочей следует немедленно промыть обожженное место сильной струей водопроводной воды, после чего наложить повязку из ваты или бинта, смоченную раствором борной кислоты или раствором таннина. Все указанные выше вещества от ожогов есть в лабораторной аптечке. При сильных ожогах после оказания первой помощи следует немедленно обратиться к врачу.
2. При попадании брызг кислоты или щелочи в глаза необходимо немедленно промыть поврежденный глаз большим количеством воды комнатной температуры, после чего сейчас же обратиться к врачу.
3. При ожоге кожи горячими предметами наложить на обожженное место сначала повязку из спиртового раствора таннина или раствора перманганата калия, а затем повязку из мази от ожогов.
4. При отравлении хлором, бромом, сероводородом, оксидом углерода(II) необходимо вынести пострадавшего на воздух, а затем обратиться к врачу.
5. При отравлении соединениями мышьяка, ртути и цианистыми солями необходимо немедленно обратиться к врачу.
Тема №2 «Приготовление растворов»
Оглавление
1. Приготовление растворов. 25
2. Определения. 27
3. Приготовление растворов для титрования и проверка нормальности по фиксаналу. 30
4. Разбавление по «правилу креста». 32
Приготовление растворов
Растворы - однородные системы, образованные двумя или большим числом компонентов. Компонент, содержание которого в растворе преобладает, обычно называют растворителем; компонент с меньшим содержанием называют растворённым веществом.
Независимо от того, какие (поточности) приготовляют растворы, применять следует только чистые растворители. Если растворителем служит вода, то можно применять только дистиллированную или деминерализованную воду, а в отдельных случаях даже бидистиллят или специально очищенную дистиллированную воду.
Предварительно подготавливают соответствующей емкости посуду (см. ниже), в которой будут готовить и хранить получаемый раствор. Посуда должна быть чистой. Если есть опасение, что водный раствор может взаимодействовать с материалом посуды, то посуду внутри следует покрыть церезином, парафином или другими химически стойкими веществами.
Перед приготовлением растворов нужно подготовить по возможности два одинаковых сосуда: один — для растворения, а другой — для хранения раствора. Может случиться, что раствор нужно будет отфильтровывать от какого-либо осадка или примеси, не растворившейся в данных условиях.
Вымытый сосуд полезно предварительно проградуировать (рис. 347). Это особенно касается бутылей большой емкости. Градуирование проводят следующим образом: мерным цилиндром отмеривают 1 л воды и переливают ее в бутыль. На стенке бутыли восковым карандашом проводят черту, совпадающую с уровнем воды в бутыли, и ставят цифру 1. Затем наливают второй литр воды и уровень отмечают цифрой 2, так проделывают до тех пор, пока бутыль не будет заполнена до плеча. Расстояние между цифрами, обозначающими целые литры, можно разделить пополам более короткой чертой. Каждая такая черта будет соответствовать 0,5 л.
Для растворения следует применять по возможности чистые вещества. Готовые растворы обязательно проверяют на содержание нужного вещества и, если это будет необходимо, поправляют растворы, т. е. добавляют в них недостающее количество вещества или воды.
Нужно принимать меры для защиты приготовленных растворов от попадания в них пыли или газов, с которыми могут реагировать некоторые растворы. Так, Щелочи следует защищать от двуокиси углерода, для этого бутыль с щелочью снабжают хлоркальциевой трубкой, заполненной натронной щелочью или аскаритом.
Как во время приготовления растворов, так и при их хранении бутыли или другая посуда обязательно должны быть закрыты предварительно подобранными пробками.
При особо точных и ответственных анализах следует обязательно принимать во внимание возможность выщелачивания стекла и применять, если это допустимо, кварцевую посуду или такую, стекло которой не содержало бы искомый элемент. Так, неизбежна ошибка при определении бора, цинка, алюминия, свинца и некоторых других элементов в посуде из стекла, содержащего эти элементы.
Определения
1) Фиксаналы
Для быстрого приготовления точных растворов различных веществ (кислот, щелочей и солей) удобно применять фиксаналы. Это — заранее приготовленные и запаянные в стеклянных ампулах точно отвешенные количества реактива, необходимые для приготовления 1 л 0,1 н. или 0,01 н. раствора.
2) Нормальная концентрация (эквивалентная) показывает количество эквивалентов растворенного вещества в 1 л раствора
Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
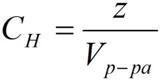
где:
СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Vр-ра – объём раствора, л.
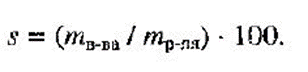 Растворимость вещества S - максимальная масса вещества, которая может раствориться в 100 г растворителя
Растворимость вещества S - максимальная масса вещества, которая может раствориться в 100 г растворителя
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
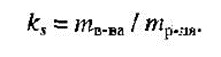
3) Титрование (от франц. titre – качество, характеристика) – один из методов количественного анализа, основанный на измерении количества реагента, который полностью реагирует с анализируемым веществом.
Например, если точно известно, какое количество гидроксида калия (в граммах или молях) израсходовано в реакции с соляной кислотой, то по уравнению реакции
KOH + HCl = KCl + H2O
легко рассчитать, сколько граммов (или молей) хлороводорода было в анализируемом растворе.
Титр – содержание вещества в граммах в 1 мл раствора:
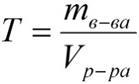
где:
T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
Vр-ра – объём раствора, мл.
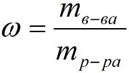
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
где:
ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
mр-ра – масса растворителя.
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:
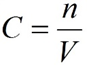
где:
C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:
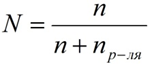
где:
N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
N(X) + N(S) = 1.
где N(X) - мольная доля растворенного вещества Х;
N(S) - мольная доля растворенного вещества S.
 2020-08-05
2020-08-05 214
214








