РЛекция 3 2011г
Химические процессы в верхних слоях атмосферы и их природа
Атмосфера Земли представляет собой динамичную и чрезвычайно сложную физико-химическую систему, структура которой обусловлена комплексом внешних и внутренних воздействий.
Диффузия
Стратификация является ее основным признаком, который, как и для других геосфер является следствием гравитационной дифференциации. Диффузное разделение (более тяжелые газы накапливаются внизу, более легкие -наверху) за длительный период существования планеты привело к тому, что нижняя часть атмосферы имеет двухкомпонентный азот-кислородный состав, а на высоте 500 - 1600 км основным компонентом атмосферы становится гелий. а выше его место занимает водород. Однако на распределение газов в атмосфере влияют и законы теплового движения (броуновского, конвективного), силы Кориолиса, приливное воздействие Луны и Солнца. Ее пронизывает излучение Солнца и испускаемые им частицы высокой энергии, а также космическое излучение. Этот поток энергии оказывает заметное химическое воздействие на атмосферу. А сама атмосфера отфильтровывает определенные диапазоны излучения, поэтому земной поверхности достигает не весь солнечный спектр. На свойства атмосферы значительное воздействие оказывают процессы происходящие на самой Земле: вулканизм, дегазация недр, жизнедеятельность биоты, и наконец, человек с его искусственно созданной системой техногенеза.
И хотя на верхние зоны атмосферы приходится лишь небольшая часть ее массы, они в значительной мере определяют жизнь на поверхности Земли, защищая нашу планету от потока лучей и града частиц высоких энергий. Но в результате такого воздействия молекулы и атомы атмосферы подвергаются различным химическим превращениям, которые мы и рассмотрим далее.
Фотодиссоциация
Солнце испускает лучистую энергию в смеси различных длин волн, а следовательно и энергии.. Коротковолновое излучение в ультрафиолетовой области спектра и рентгеновские лучи обладает высокой энергией, вызывающей химические реакции, которые могут быть каскадными. При этом энергия фотона (Е = hn) должна быть достаточна для разрыва химической связи в молекуле и инициирования процесса. Кроме того, молекулы должны поглощать фотон, энергия которого должна превращаться в какую-либо иную форму.
- Фотодиссоциация молекулы кислорода: наиболее важная реакция для обеспечения жизни на Земле -
О2 (г) + hn® 2 О (г). (1)
Максимальная энергия, которая необходима для такого превращения, равна 495 кДж/моль. Можно выполнить нетрудный расчет и определить, что любой фотон с длиной волны менее 242 нм имеет достаточную энергию для этой реакции (чем короче волна, тем выше энергия).
К нашему счастью, молекулы О2 поглощают большую часть коротковолнового излучения с высокой энергией, прежде чем оно достигнет нижней части атмосферы. При этом образуется атомарный кислород. На высотах около 400 км диссоциировано 99% молекул кислорода, на долю молекул О2 остается тлько 1%. Ниже на высоте 130 км содержание О2 и О одинаково. На меньших высотах доля молекулярного кислорода возрастает.
Фотодиссоциация азота
Энергия диссоциации молекулы N2 очень велика, значит, разорвать молекулу могут только фотоны с чрезвычайно высокой энергией.. Таких фотонов в солнечном спектре немного, да и молекула азота плохо поглощает фотоны, даже если их энергия окажется достаточной. Вследствие такого процесса атомарного азота в атмосфере очень мало.
Фотодиссоциация воды. Концентрация паров воды значительна вблизи поверхности Земли, но быстро уменьшается с высотой. На высоте 30 км (стратосфера) паров воды три молекулы на миллион молекул смеси. Однако, оказавшись в верхних слоях, вода подвергается фотодиссоциации:
Н2О (г) + hn®= Н (г) + ОН (г); (2)
ОН (г) + hn®= Н (г) + О (3)
Ионизации
Фотодиссоциация (уравнения 1-3) осуществляется не прямо, но через процесс ионизации. В 1924 году было установлено, что в верхних слоях атмосферы имеются свободные электроны, а по закону баланса зарядов должны быть и положительно заряженные ионы. Откуда же берутся эти ионы? В меньшей мере от воздействия электронов, прилетающих от Солнца вместе с солнечным ветром, а в большей мере - вследствие фотодиссоциации. При воздействии фотона молекула в начале может поглотить его, не расщепляясь при этом на атомы. Фотон выбивает из молекулы электрон самого слабого верхнего уровня, и образуется молекулярный положительный ион. Таким же образом может подвергнуться ионизации и нейтральный атом.
Фотоны, вызывающие ионизацию, по своей энергии относятся к высокочастотной коротковолновой области в пределах ультрафиолета. Это излучение не доходит до поверхности Земли, его поглощают верхние слои атмосферы (табл. 1).
Таблица.1
Реакции ионизации и затраты энергии на неё
| Уравнение реакции | Энергия ионизации кДж/моль | Длина волны, нм |
| N2 + hn®= N2+ + e | 1495 | 80,1 |
| O2 + hn®= O2+ + e | 1205 | 99,3 |
| O + hn® =O+ + e | 1313 | 91,2 |
| NO + hn®= NO+ + e | 890 | 134,5 |
4. Диссоциативная рекомбинация. Образующиеся молекулярные ионы обладают очень большой реакционной способностью, быстро реагируют с любыми другими частицами при столкновении, эти реакции носят экзотермический характер. Но так как при высоком разряжении отдача избыточной энергии маловероятна, то более вероятна рекомбинация иона с электроном, сопровождающаяся диссоциацией молекулярных ионов с образованием нейтральных атомов:
N2+ + 2 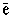 ® N (г) + N (г);
® N (г) + N (г);
O2+ + 2 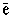 ® O (г) + O (г);
® O (г) + O (г);
NO+ +2 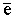 ® N (г) + O (г).
® N (г) + O (г).
Такие реакции называются реакциями диссоциативной рекомбинации. Атомарный азот в верхних слоях атмосферы образуется исключительно в результате такой реакции.
5. Перенос или обмен заряда. Когда молекулярный ион все же сталкивается с какой-либо нейтральной частицей, между ними может произойти перенос электрона: N2+ (г) + О2 (г) ® N2 (г) + О2+ (г). Это возможно, если Е1(O2)< E2(N2), то есть энергия ионизации молекулы, теряющей электрон, должна быть меньше энергии молекулы, приобретающей электрон (реакция должна быть экзотермическая).
О+(г) + О2(г) ® О (г) + О2+ (г);
 О2+(г) + NО (г) ® О2 (г) + NО+ (г);
О2+(г) + NО (г) ® О2 (г) + NО+ (г);
N2+(г) + NО (г) ® N2 (г) + NО+ (г).
Реакции переноса заряда играют большую роль во многих областях химии, особенно в биохимии. Реакции переноса заряда не сопровождаются разрывом химических связей, осуществляется только перенос электрона от одной частицы к другой.
 2020-08-05
2020-08-05 110
110







