Эта проблема привлекает все большее внимание клиницистов (Н. Н. Блохин, 1957; Ю. Е. Березов, 1961; В. М. Ефетов, 1961; А. М. Суслов, 1961; Е. Г. Фридман, 1963; А. А. Климен-
ков, 1964; McNeer et al., 1950; Hoffman, 1956).
Классификация рака резецированного желудка:
1. Рецидив рака в резецированном желудке или пищеводно-кишечпом анастомозе.
Рецидивы рака в оставшейся части желудка чаще всего являются
•следствием недостаточно высокого уровня резекции из-за недоучета особенностей распространения рака по желудочной стенке за пределы видимой опухоли. По времени развития целесообразно выделять ранние и поздние рецидивы — соответственно до и свыше 5 лет после резекции желудка. Рецидивы рака желудка наблюдаются у 20—60% больных.
2. Экзогастральный рецидив рака желудка.
Особую группу составляют таи называемые экзогастральные, или перивептрикулярные, рецидивы, т. е. регионарпые метастазы первично удаленного рака желудка, которые при своем прогрессивном росте прорастают стенку желудка и анастомоз, давая клинику, характерную для истинного рецидива рака желудка. Чаще всего эти метастазы локализуются в неудаленной части малого сальника и забрюшинных лимфатических узлах. По времени развития соответствуют раннему рецидиву рака желудка.
3. Рецидив рака в культе двенадцатиперстной кишки после резекции желудка в модификации Бильрот II.
Рецидивы рака в культе двенадцатиперстной кишки целиком зависят
•от инвазии раковых клеток из желудка. Сравнительная редкость сообщений. об этих рецидивах можно объяснить трудностью, а порой и невозможностью их прижизненной диагностики.
4. Рак желудка после резекции по поводу язвенной болезни. Наблюдается от 0,1 до 4,9% (С. А. Зарубин, 1959; Helsingen, llillested, 1956; Ropant, 1961, и др.). Этнологическими факторами развития рака в резецированном желудке является хронический ахилический гастрит, механические и химические раздражения области анастомоза с частым развитием анастомозитов. В среднем развитие рака в резецированном желудке наблюдается через 15—20 лет после первой резекции. После гастроэнтеростомии опухоль развивается еще позже, через 20—30 лет.
5. Рак желудка после резекции по поводу полипов.
Множественность полипов, частое раковое превращение, сочетание рака и полипов желудка, рецидивы полипов и развитие рака резецированного желудка — основные этиологические моменты. Наблюдается у,8—10% больных.
При раке резецированного желудка ранние клинические симптомы отсутствуют, так как в известной мере замаскированы симптоматикой оперированного желудка. Наличие светлого промежутка, т. е. периода полного благополучия от момента первой операции до появления жалоб, является типичным для рака резецированного желудка. Длительность светлого промежутка может варьировать от нескольких месяцев до десятков лет. В случае развития рецидива длительность светлого промежутка имеет существенное прогностическое значение — чем длительнее светлый промежуток, тем более ве
роятен успех повторной операции и наоборот. Клинические симптомы рака резецированного желудка не отличаются от симптомов рака неоперированного желудка. Слабость и утом^ ляемость, похудание, снижение аппетита, тяжесть и боли в. эпигастральной области, а также развитие гипохромной анемии — наиболее типичные признаки всех видов рака резецированного желудка. При ранних рецидивах рака желудка, в связи с преобладающей локализацией опухоли в области анастомоза, определяющим в клиническом течении является стеноз анастомоза, что проявляется рвотой пищей, резким истощением и обезвоживанием. При поздних рецидивах, а также в случае развития рака после резекции по поводу язвенной болезни или нолипоза, вследствие частой локализации опухоли в области кардии культи желудка, на первый план выступает дисфагия, которая характерна только для этой группы больных, и в ряде случаев может быть ранним признаком.
Огромное значение для распознавания рака резецированного желудка или рецидива рака и анастомозе с пищеводом имеет рентгенологическое исследование. Использование методики пиелморельефа, двойного контрастиропания позволяет выявить. ранние признаки рака культи желудка на топ стадии опухолевого процесса, когда повторная операция является радикальной. Эндоскопический метод позволяет не только дополнить данные предыдущего, но и выполнить биопсию и получить морфологическое подтверждение диагноза. Следует подчеркнуть, что при малейшем подозрении на рак резециронан-ного желудка больной должен быть направлен в стационары) для комплексного обследования,
Лечение. Радикальное хирургическое лечение. Основным видом радикального лечения рака желудка является хирургический метод.
Для решения вопроса о показания х к операции у больного раком желудка необходимо провести весь комплекс диагностических мероприятий, включающий общеклипический, рентгенологический и эндоскопический методы. Общеклиническая оценка состояния больного составляет основу для правильного и целенаправленного применения многочисленных специальных методов уточненной диагностики. Одним из ведущих является рентгенологический метод, который позволяет выявить не только локализацию опухолевого процесса и его протяженность по желудку, но и вовлечение в процесс привратника или пищевода, определить анатомический тип опухоли и состояние соседних с желудком органов. Этот метод дает также возможность определить степень инфильтрации стенки желудка и состояние перистальтики, что особенно важно в диагностике инфильтративного рака. Быстрое развитие фиб-рогастроскопической техники сделало доступным тщательный визуальный осмотр всего желудка; поэтому диагноз рака дол-
жен обязательно базироваться на данных гастроскопии с биопсией. Эта методика позволяет непосредственно осмотреть опухоль, дополнить данные рентгенологического исследования и в ряде случаев избежать ошибок. Фиброгастро-с к опия более точно определяет границы распространения опухоли, анатомический тип ее роста, позволяет оценить состояние слизистой оболочки желудка вокруг опухоли и, главным образом, в той части, которую хирург собирается оставить. Но иногда только общеклиническое обследование без привлечения дополнительных методов позволяет высказаться довольно точно о распространенности опухолевого процесса.
Появление болей в спине за несколько месяцев до госпитализации должно насторожить врача в отношении поражения забрюшинных лимфатических узлов или прорастания опухоли желудка в поджелудочную железу и другие забрюшинные органы. Резкое истощение не всегда является признаком безнадежного состояния. Оно может быть связано с небольшой опухолью в кардиальном отделе или пищеводе, которая приводит в течение короткого периода голодания к кахексии. Для решения вопроса о возможности выполнения радикальной операции у онкологического больного, отягощенного сопутствующими заболеваниями, необходимо прибегать к помощи смежных специалистов — гинекологов, терапевтов, фтизиатров, анестезиологов и т. д.
Противопоказаниями к радикальному оперативному лечению рака желудка служат асцит, определяемый клинически, желтуха, обусловленная метастазами в печень, отдаленные метастазы (Вирхова, Шнитцлера, Крукенберга), метастазы в пупок, средостение, легкие и т. д. В таких случаях целесообразно обсудить показания к паллиативной операции. Наличие пальпируемой малоподвижной опухоли не всегда является основанием для отказа от операции, так как во время ревизии и мобилизации в ряде случаев удается выделить желудок вместе с опухолью и выполнить радикальное вмешательство. При наличии кровоточащей раковой опухоли в отсутствии эффекта от консервативного лечения показано оперативное лечение, окончательный объем которого выясняется после лапа-ротомии и ревизии. В случае сомнительной операбельности необходимо оперировать больного, ибо только такая мера позволит правильно оценить состояние больного и избежать ошибки. При наличии признаков неоперабельности рекомендуется консервативная терапия и только по жизненным показаниям может стать вопрос о лапаротомии с выполнением минимального паллиативного вмешательства, например перевязки крупных магистральных сосудов (Б. Е, Петерсон, А. М. Липатов, В. И. Плотников, 1973). В случае прободения раковой язвы с соответствующей клинической симптоматикой при общем удовлетворительном состоянии больного целесообразно произвести резекцию желудка. При тяжелом состоянии,
наличии противопоказаний и несвоевременно распознанном прободении необходимо ограничиться ушиваппем прободного отверстия и дренированием брюшной полости. После выведения больного из тяжелого состояния и проведения соответствующей подготовки следует оперировать в возможно короткий срок.
К неонкологическим противопоказаниям относятся сопутствующие заболевания в стадии декомпенсации, преклонный возраст, низкие функциональные показатели, некомпснсиро-..ванпьте эндокринные расстройства, кахексия с грубыми нарушениями белкового и электролитного обмена и тяжелые анемии. Совокупность всех этих факторов требует тщательной оценки, основанной на функциональном обследовании, чтобы с предельной достоверностью определить степень операционного риска и выработать систему предоперационной подготовки.
В последние годы отмечается тенденция к расширению по-.казаный к оперативному лечению больных в преклонном возрасте, а также с сопутствующими заболеваниями, которые, по общему убеждению, составляют значительный резерв расширения возможностей хирургии рака желудка. В связи с общей тенденцией к увеличению средней продолжительности жизни онкологу и хирургу, оперирующему на желудке, все чаще придется иметь дело с подобной категорией больных.
Как было сказано выше. основным методом радикального лечения больных раком желудка является операция, объем •которой выбирается строго индивидуально с учетом индивидуальных особенностей больного. Так. при большой опухоли с поражением всех регионарпых лимфатических барьеров, но без отдаленных метастазов необходимо выполнять операцию максимального объема. При малом раке в пределах слизистой оболочки можно выполнить небольшую резекцию (например 2/3 желудка), по при этом максимально убрать весь регионар-ный лимфатический аппарат, так как нельзя гарантировать отсутствие метастазов даже при таких формах рака желудка. Макроскопический тип роста опухоли играет существенную
-роль при выборе показаний к оперативному вмешательству. При экзофитных опухолях допустимо максимальное расширение показаний, так как эти опухоли склонны длительно расти местно и не давать метастазов.
В случае сомнительной операбельности при экзофитпом раке •желудка после тщательного комплексного обследования необходимо прибегнуть к операции как к последнему этапу диагностики. При отсутствии признаков иноперабельности выполняется радикальное вмешательство, которое при подобных опухолях дает хорошие отдаленные результаты. При инфиль-тративпом типе роста опухоли и сомнительной операбельности, выявленной при обследовании, лучше отказаться от операции, так как в таких случаях получены самые плохие отдаленные результаты (М. Ш. Ахметов, 1971). В случае прорастания эк-зофитной опухолью соседних органов без отдаленных метастазов показана комбинированная резекция желудка. В такой же ситуации при инфильтративной опухоли надо отказаться от комбинированной операции. В случае инфильтративпого рака резекция желудка или гастрэктомия наиболее оправданы при отсутствии регионарных метастазов или наличии их в первом лимфатическом барьере. Высокодифференцированные раковые опухоли желудка позволяют расширять показания к операции даже в сомнительных в смысле операбельпости случаях. Эти опухоли растут медленно, реже метастазируют и плохо поддаются лекарственной терапии. При более агрессивных недифференцированных опухолях и сомнительной операбельности лучше отказаться от выполнения резекции желудка или гастрэктомии.
В онкологической практике прочно утвердились три основных типа радикальных оперативных вмешательств: 1) дистальная субтотальная резекция желудка; выполняемая чрез-брюшинно, 2) проксимальная субтотальная резекция желудка, выполняемая чрезбрюшинным и чресплевральным доступами, 3) гастрэктомия, выполняемая чрезбрюшинным или чресплевральным доступами.
Резекция меньшего объема (2/3 или 3/4 желудка) применяется только при небольших экзофитных опухолях пилороапт-рального отдела или как паллиативное вмешательство.
Субтотальная резекция желудка (рис. 76) выполняется при экзофитных опухолях пилороаптрального отдела, не распространяющихся далее угла желудка и в виде исключения допустима при небольших инфильтратикных опухолях пилороантрального отдела. Особенность субтотальной резекции заключается в широкой мобилизации желудка 'вместе с большим и малым сальниками, высокой перевязке левой желудочной артерии-в желудочно-поджелудочной связке (у места отхождения от чревной артерии), полном удалении всей малой кривизны вместе с сальником и той его частью, в которой расположены паракардиальные лимфатические узлы, пересечении двенадцатиперстной кишки, отступя от привратника вниз на 2—3 см. Линия пересечения желудка по малой кривизне должна находиться на уровне пищевода, а по большой — на уровне нижнего полюса селезенки. Операция закапчивается формнрованисм-желудочно-кишечного соустья по любому ил известных методов, наиболее распространены способы Бильрот 2 и I.
В истории хирургии увековечено имя Бильрота, который предложил два классических метода резекции желудка. При раке желудка наибольшее распространение получил второй метод резекции, разработанный Бильротом в 1885 г. При этом методе автор предложил разъединять

Рис. 76. Удаляемая часть желудка при субто-талъичй резекции.
двенадцатинерстиую кишку с желудком и закрывать ее наглухо, а просвет желудка по линии резекции зашивать полностью и накладывать гастро-эптероацастомоз на остающуюся часть желудка. Анастомоз накладывался на длинной петле с энтсроэптероаиастомозом впереди поперечной ободочной кишки. Эта методика подверглась впоследствии многочисленным модификациям. Что касается своего первого способа резекции желудка, то Бильрот описал ее в 1881 г., но но праву она должна называться операцией Пеана — Бпльрота, так как Пеан произвел эту операцию раньше Бильрота, о чем свидетельствует его запись в 1879 г. Причиной непризнанного приоритета Пеана явился плохой исход его операции.
Резекция желудка но Бильрот I заключается в соединении двенадцатиперстной кишки с желудком после частичного ушиватшя его просвета (рис. 77). Эта операция, иначе называемая гастродуоденоанастомозом, не имеет широкого распространения в онкологических учреждениях, несмотря па то, что ое физпологичность общепризнана, а оперативное вмешательство значительно короче по времени. Существует мнение, что резекция по Бильрот I проводится менее радикально, так как хирург, боясь натяжения анастомоза и последующей несостоятельности швов, оставляет более значительный отрезок желудка. Подобные осложнения возникают не от завышения размеров резецируемой части желудка, а в связи с ошибочными показаниями к этому виду резекции. Ведь в соответствующих случаях рака желудка можно произвести не только гастродуо-деноапастомоз, но и эзофагодуодепоапастомоз. В результате этой операции удается удалить не только пораженную опухолью часть желудка, но и лимфатические узлы первого, второго этапов метастазироваяия I и II бассейнов.

Рис. 77. Резекция желудка по Бильрот 1.
Проксимальная субтотальная резекция, как правило, выполняется при экзофитных опухолях проксимального отдела желудка. При расположении экзофитной опухоли в теле желудка или тотальном поражении, а также инфильтрирующей опухоли любой локализации необходимо выполнять гастрэктомию. При врастании опухоли в поперечную ободочную кишку, поджелудочную железу, селезенку, левую долю печени при отсутствии отдаленных метастазов показана комбинированная операция — субтотальная резекция или гастрэктомия с резекцией или уда-леншем пораженного органа единым блоком. Резекция брыжейки поперечной ободочной кишки и листка париетальной. брюшины над поджелудочной железой не усложняет операцию и такое вмешательство не следует относить к комбинированным. Комбинированные операции выполняются у 30—50% всех радикально оперированных больных (Б. А. Королев, А. Н. Симонович, 1962; А. И. Саенко, 1973; Б. Е. Петерсон, 4971) и несмотря на то, что они сопровождаются более высокой послеоперационной летальностью (А. И. Саенко, 1973), отдаленные результаты лечения следует считать удовлетворительными.
Для окончательного определения операбельности на операционном столе необходимо пользоваться оптимальным и широким оперативным доступом. Для дистальных резекций желудка и гастрэктомии при локализации рака в теле желудка, субкар-диального отдела без перехода на пищевод наибольшее распространение получил чрезбрюшинный доступ, выполняемый из верхнесрединного разреза. Подобный разрез при необходимости может быть продлен кверху с обходом мечевидного отростка слева, рассеченгюм пли резекцией последнего. Иногда Срединный разрез может быть дополнен поперечным разрезом прямой мышцы живота. При раке тела, субкардиального и проксимального отделов желудка с переходом па пищевод оптимальным является левосторонний чресплевральный доступ, позволяющий провести достаточно полную ревизию органов брюшной и грудной полости. При этом доступе пораженные отделы желудка, пищевода, а также окружающие и прилегающие органы (левая доля печени, селезенка, тело и хвост поджелудочной железы, диафрагма) хорошо экспонируются. Этот доступ отвечает всем принципам абластики и позволяет выполнить операцию самого большого объема, а также пересечь пищевод на достаточном расстоянии от макроскопической границы опухоли.
Формирование анастомоза с пищеводом осуществляется в условиях удовлетворительной видимости при минимальных технических сложностях достаточно надежно. При совершенном наркозе и проведении интенсивной терапии после операции торакотомия не опасна и не тяжела для больного. При таком доступе Проксимальная резекция желудка или гастрэктомия производится более широко и, следовательно, более радикально. При наличии противопоказаний или невозможности выполнения торакотомии возможно выполнить прокси-мальную резекцию желудка пли гастрэктомию по Савиных. Сущность этого метода заключается в выделении пищевода из средостения путем сагиттальной диафрагмокруротомии.
Субтотальная дистальная резекция желудка. Положение больного на операционном столе— па спине с подложенным под спину па уровне мечевидного отростка валиком. Выполняют верхнесрединную лапаротомию. По вскрытии Срюшной полости производят ревизию. При отсутствии признаков иноперабельности начинают мобилизацию желудка по -большой кривизне путем отделения салышка от поперечной ободочной кишки (рис. 78).
Обнажив заднюю степку желудка, определяют состояние желудочно-поджелудочной связки: ее длину, наличие метастазов, прорастания опухоли в поджелудочную железу. При отсутствии признаков иноперабельности продолжают мобилизацию большого сальника. Левый край сальника продолжается к воротам селезенки, переходя далее в желудочно-селезеноч-ную связку и широко срастается с толстой кишкой и ее брыжейкой. Здесь пересекают и перевязывают левую желудочио-сальпиковую артерию и соответствующие вены (рис. 79). Далее аналогичным образом сальник отсекают справа до печеночного изгиба поперечной ободочной кишки. Здесь же перевязывают правую желудочно-сальниковую артерию и вену. На уровне привратника листки желудочно-ободочной связки расходятся, и задний листок ее срастается с верхним листком
брыжейки поперечной ободочной кишки, поэтому при мобилизации необходимо расслоить брыжейку поперечной ободочной кишки и отодвинуть к желудку ретропилорические лимфатические узлы, расположенные у головки поджелудочной железы и по нижнему краю горизонтальной ветви двенадцатиперстной кишки.
После этого приступают к мобилизации двенадцатиперстной кишки, для чего пересекают и перевязывают ветви желудочно-двенадцатиперстной артерии, идущие в вертикальной части кишки (рис. 80, 81, 82). Пересекают п перевязывают правую желудочную артерию у верхнего края двенадцатиперстной кишки, отступя на 3—4 см от привратника. Мобилизовать двенадцатиперстную кишку следует на протяжении не менее 4—5 см, что необходимо для надежного укрытия ее культи, а также унесения не менее 2 см стенки кишки. Далее производят мобилизацию желудка по малой кривизне (рпс. 83). У основания желудочно-поджелудочной связки подсекают листок задней брюшины и всю клетчатку вместе с лимфатическими узлами отсепаровывают в сторону желудка с последующей перевязкой левых желудочных артерий и вены у места отхож-денпя левой желудочной артерии от чревной (рис. 84, So). После мобилизации и пересечения связок желудка хирург должен уточнить границы резекции желудка и выяснить возможности выполнения операции Бильрот I без ущерба для принципов абластики. Во всех остальных случаях рекомендуется отказаться от этого вида анастомоза и операцию закончить по Бильрот II. После этого в рану выводят поперечную ободочную кишку. В ее брыжейке проделывают острым путем окно и через него проводят петлю топкой кишки, взятую на расстоянии 10—20 см от трейцевой связки.
Далее приступают к пересечению двенадцатиперстной кишки по намеченной линии, предварительно отграничив операционное поле от свободной брюшной полости марлевыми салфетками. На кишку накладывают 2 зажима (при анастомозе по Бильрот I целесообразно накладывать не раздавливающий, а мягкий зажим), отступя 1,5—2 см от привратника вниз и рассекают кишку (рис. 86). Края пересеченной кишки обрабатывают спиртовым раствором йода, а край желудка изолируют марлевой салфеткой и отводят влево. В ряде случаев, когда невозможно перевязать левую желудочную артерию без пересечения двенадцатиперстной кишки, допустимо применить обратный порядок, при котором сначала пересекают и обрабатывают культю двенадцатиперстной кишки, а затем перевязывают левую желудочную артерию. Существенным недостатком при этом является то, что «грязные» этапы операции предшествуют «чистым», что может быть причиной нарушения асептики. При ручном способе укрытия культи дпепадцати-перстной кишки используют двухрядный шов, при котором
первый ряд накладывается с помощью обвивного кетгутового или, как это принято в нашей клинике, обвивного шелкового шва.
Отступя от зажима вниз на 1,5—2 см, а по передней стенке на 2 см, накладывают шелковый кисетный шов. Затем зажим с культи снимают и кишку туго затягивают обвивным швом. После обработки культи йодом ее погружают в кисетный шов. Более надежным способом ушивапия культи двенадцатиперст-яой кишки, особенно при ее широком диаметре, является наложение двух полукисетных швов на кишку, ушитую непрерывным швом. Дополнительно кишку ушивают узловыми швами и укрывают капсулой поджелудочной железы. Наиболее распространено ушивание культи двенадцатиперстной кишки аппаратом УКЛ-60 или УКЛ-40. После прошиванпя кишки линия скрспочного шва погружается с помощью двух полу-кисстпых швов с дополнительной перитонцзацией капсулой поджелудочной железы. Этот способ более надежно укрывает культю и значительно сокращает время операции. После этого приступают к резекции желудка, для чего малую кривизну скелетируют от уровня пищевода в сторону желудка на протяжении 4—6 см (рис. 87). Целостность брюшного покрова у пищевода восстанавливается несколькими серо-серозными швами.
Далее описываем наиболее принятую операцию Бильрот II, которая более всех методик резекции желудка выдержала испытание временем. На желудок накладывают зажим, начиная от места впадения пищевода в желудок по направлению к нижнему полюсу селезенки. На уходящую часть желудка накладывают общий зажим, после чего желудок отгораживают от брюшной полости марлевыми салфетками. Производят отсечение и удаление препарата. Край обреза обрабатывают спиртовым раствором йода. На оставшуюся часть желудка ближе к пищеводу накладывают либо непрерывный обвивной, ливо матрацный гемостатический шов так, чтобы не сузить просвет пищевода. Второй ряд серозно-мышечных швов накладывают, перитонизируя непрерывный. Подготовленную ранее для анастомоза петлю тонкой кишки подшивают отдельными серо-серозными швами к задней стенке желудка по линии предполагаемого анастомоза, отступя на 0,5 см. Вскрывают просвет кишки и на заднюю стенку желудка и топкой кишки накладывают непрерывный обвивпой кетгутовый шов, который затем переходит и на переднюю стенку. В ряде случаев целесообразно начинать этот шов с середины и заканчивать
•его на передней стенке — также на середине анастомоза. После завершения непрерывного шва накладывают второй ряд узловых серо-серозных швов на переднюю стенку. При проверке анастомоз должен свободно пропускать концы 2—2,5 пальцев. Операцию закапчивают фиксацией оставшейся части желудка в окне брыжейки поперечной ободочной кишки отдельными узловыми швами (рис. 88).
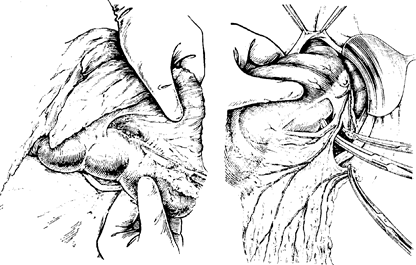
Рис. 78. Отделение большого сальника от поперечной ободочной кишки.
Рис. 79. Подготовка к перевязке желудочной ветви левой желудочно-сальниковой артерии. Сальниковая ветвь этой артерии рассечена между зажимами.
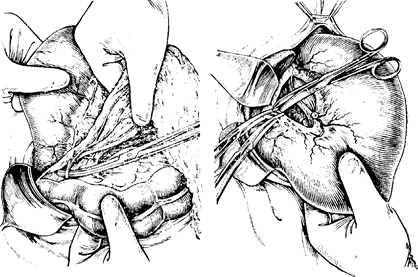
Рис. 80. Окончание отделения сальника, подготовка к перевязке правой желудочио-сальниковой артерии.
Рис. 81. Пересечение правой желудочной артерии.
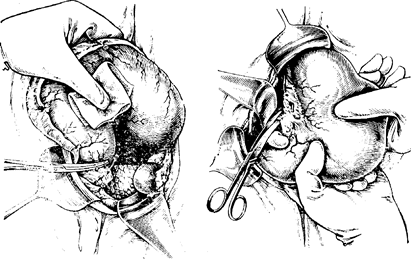
Рис. 82. Подготовка к перевязке ветвей желудочно-двенадцатиперстной артерии.
Рис. 83. Мобилизация малой кривизны желудка. Рассечение малого сальника.
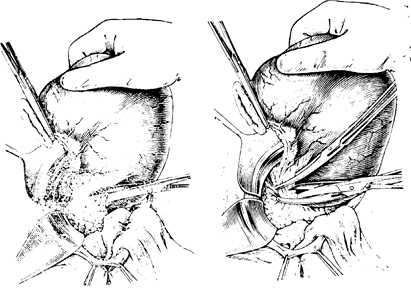
Рис. 84. Рассечение желудочно-поджелудочной связки.
Рис. 85. Пересечение левой желудочной артерии.
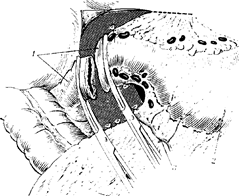
Рис. 86. Пересечение двенадцатиперстной кишки между двумя зажимами.
1 — двенадцатиперстная кишка; 2 — желудок; 3 — правая желудочно-салышковая артерия;
4 — сальник.

Рис, 87. Желудок откинут кверху и влево. Наложены зажимы на 2/з ширины желудка и на малую кривизну.
1 — сальник; 2 — желудок; 3 — селезенка;
4 — диафрагма; 5 — пищевод; 6 — селезеночная артерия; 7 — печеночная артерия;
8 — левая желудочная артерия; 9 — лимфатические узлы; 10—двенадцатиперстная кишка.
Перед зашиванием брюшную полость следует осушить. Особенно тщательно надо осушить оба латеральных канала, область селезенки и поддиафрагмального пространства, где довольно часто оказываются сгустки крови. Брюшную полость ушивают наглухо. Когда у истощенного больного проводится большая комбинированная операция с удалением или резекцией одного или нескольких органов в верхнем этаже брюшной полости остается значительное пространство, которое первые послеоперационные дни заполнено воздухом, а в последующем экссудатом. В этих случаях органы медленно заполняют образованное пространство и могут возникнуть условия для развития абсцесса. Предвидя такую возможность, необходимо через дренаж, введенный в образовавшуюся полость, осуществлять активную аспирацию остаточного воздуха в первые 2 дня с помощью вакуумного аппарата, что способствует быстрейшей ликвидации остаточной полости.
 Рис. 88. Анастомоз при субтоталъной резекции желудка.
Рис. 88. Анастомоз при субтоталъной резекции желудка.
При создании анастомоза по типу Бильрот I не следует чрезмерно мобили-зовывать двенадцатиперстную кишку, так как это приводит к нарушению ее питания. Анастомоз между оставшейся частью желудка и двенадцатиперстной кишкой осуществляется с помощью двурядного шва по типу конец в конец. В ряде случаев целесообразно использовать растягивающий непрерывный шов по Н. Н. Блохину (см. описание гастрэктомии). Касаясь сравнительной оценки различных типов же-лудочно-кишечных анастомозов, следует отметить, что метод Бильрот I более физиологичен. Он сохраняет пассаж пищи по двенадцатиперстной кишке и тем самым не нарушает нормального процесса пищеварения. Однако этот метод при операциях по поводу рака желудка допустимо применять только в тех случаях, когда не нарушаются правила абластики и остается большая часть желудка по большой кривизне, позволяющая без натяжения соединить ее с двенадцатиперстной кишкой. Какие-либо приемы мобилизации двенадцатиперстной кишки для подтягивания ее к желудку недопустимы. Опыт показывает, что примерно у V4 больных раком желудка субтотальную резекцию можно выполнять по методу Бильрот I. Ставить перед собой цель обязательно выполнить операцию по Бильрот I хирург не должен, так как операция по Бильрот II, выполненная по всем правилам, также приводит к хорошим функциональным результатам и почти не дает осложнений в виде демпинг-синдрома и др.

Рис. 89. Место пересечения желудка при гастрэктомии.
Гастрэктомия. Гастрэктомией следует называть такую операцию, при которои гистологическое исследование препарата показывает наличие плоскоклеточного эпителия пищевода по линии верхнего разреза и кишечного — по линии нижнего разреза (рис. 89). Первая гастрэктомия была успешно выполнена в 1897 г. Schlatter в клинике Kronlein. Две подряд успешные гастрэктомии в России были выполнены в Москве В. М. Зыковым в 1910 г. Гастрэктомия чрезбрюшинным доступом производится при поражении тела желудка, суб-кардиального отдела, тотальном поражении желудка без перехода на пищевод. При распространении опухоли на пищевод операция выполняется трансторакальным доступом. Разрез в седьмом или восьмом межреберье слева продолжается на переднюю брюшную стенку с пересечением реберных хрящей. Этот доступ обеспечивает ревизию органов брюшной полости и манипуляции в ней. При чрезбрюшинной гастрэктомии больного укладывают на спину с валиком, подложенным на уровне мечевидного отростка. Доступ — верхнесрединная лапаротомия, которая продолжается слева, обходя пупок.
В ряде случаев показано рассечение или резекция мечевидного отростка.
По вскрытии брюшной полости проводят тщательную ревизию и при отсутствии признаков иноперабельности выполняют радикальную операцию. Подготовительные этапы к гастрэк-томии не отличаются от таковых при субтотальной резекции. Мобилизацию желудка производят так же, как и при субтотальной резекции. После этого пересекают короткие желудочные артерии ближе к паренхиме селезенки. В ряде случаев гастрэктомию целесообразно начинать с мобилизации левой доли печени путем пересечения левой венечной связки и выделения пищевода. Левую желудочную артерию перевязывают у места отхождения ее от чревной. После окончания мобилизации и пересечения всех связок желудка петлю тощей кишки проводят через окно брыжейкп поперечной ободочной кишки для анастомоза с пищеводом. Пересекают двенадцатиперстную кишку, ушивают ее по одному из описанных способов. В ряде случаев прибегают к обратному порядку: сначала пересекают двенадцатиперстную кишку, отсекая от нее желудок, и после перитонизации культи приступают к перевязке левой желудочной артерии. Самым сложным и ответственным моментом гастрэктомии является наложение анастомоза с пищеводом. При формировании анастомоза следует стремиться не только к надежности швов, но и к обеспечению хорошей функции замыкания (взамен удаленной кардии) в отдаленные сроки. Среди многочисленных методов соединения пищевода с кишкой, предложенных на протяжении столетней истории гастрэктомин, наиболее отвечает современным требованиям янвагинационный анастомоз, предложенный Ф. Ф. Березки-ным (1940) и усовершенствованный К. П. Цацаниди (1965) в клинике, руководимой В. И. Казанским. Проводя сравнительную оценку различных пищеводно-кишечных анастомозов в эксперименте и клинике и имея опыт около тысячи таких операций па протяжении 20 лет, клиники ОНЦ АМН СССР пока не изменили своего мнения: любой тип пищеводно-ки-шечного анастомоза не гарантирует от развития недостаточности швов, рефлюкс-эзофагита и рубцового сужения. Однако инвагипационный метод дает минимальное число подобных осложнений.
Анастомозы (вертикальные и горизонтальные), выполненные двухрядным швом в различных модификациях, дают максимальный процент недостаточности швов. Меньший процент осложнений при инвагинационном пищесо дно-кишечном анастомозе зависит от того, что при нем значительно отдален (на 2—3 см) первый ряд швов, проведенный через все слои, от второго ряда погружпых швов и плоскость соприкосновения мышечной стенки пищевода с серозной оболочкой кишки очень •большая, что предохраняет от развития инфекции в зоне анастомоза и вокруг него и обеспечивает максимальную регенерацию. Погруженный в просвет кишки анастомоз по типу конец в конец создает мощную складку, препятствующую забрасыванию кишечного содержимого в пищевод, как в чернильнице-«непроливайке».
Перед наложением анастомоза необходимо оценить, достаточно ли мобилизован пищевод. Должны быть пересечены оба блуждающих нерва у стенки пищевода как можно выше. Если брюшной отдел пищевода короток или выявляется высокая опухолевая инфильтрация пищевода, возникает необходимость мобилизации пищевода по Савиных. Для этого, мобилизуют левую долю печени путем пересечения печеночно-диа-фрагмальной связки и перемещают ее вправо. Пересекают ножки диафрагмы и впереди от пищевода производят сагиттальную днафрагмотомию. Диафрагма смещается вверх и обнажается нпжнегрудпой отдел пищевода. Для анастомоза с пищеводом проведенную позадиободочно петлю тощей кишкп освобождают от брыжейки на расстоянии 3—4 см. Эта часть кишки будет участвовать в ипвагипации будущего анастомоза. Отделить брыжейку от кишки необходимо для того, чтобы она не сдавливала анастомоз. Кровоснабжение кишки, лишенной брыжейкп на таком протяжении, существенно не страдает. Кишку пересекают между двумя зажимами. Затем накладывают два длинных шелковых шва между кишкой и пищеводом на задней стенке, отступя от края кишки и линии предполагаемого пересечения пищевода на 2—3 см. Эти швы завязывают после анастомозировапия пищевода с кишкой конец в конец. С их помощью осуществляется инвагинация задней стенки анастомоза. После этого послойно пересекают пищевод:
сначала мышечную, а затем слизистую оболочку, отступя от наложенных инвагинационных швов на 2—3 см. Накладывать зажим на пищевод нецелесообразно, так как он травмирует рыхлую ткань пищевода. Введенный до операции зонд в пищевод гарантирует от затекания содержимого пищевода в рану. Далее сшивают 5—6-узловыми шелковыми швами заднюю стенку пищевода и кишки через все слои. Крайние швы вдевают в длинную режущую иглу, которую проводят в просвет кишки и выкалывают на ее передней стенке на расстоянии 8—10 см от линии предполагаемого анастомоза. Это так называемые швы-держалки, потягивая за которые в последующем будет осуществляться инвагинация анастомоза в кишку. Для погружения необходимо выделить пищевод на протяжении 2—3 см. Более высокое выделение стенки пищевода может нарушить кровоснабжение его в области анастомоза. Далее накладывают 5—б узловых шелковых швов на переднюю стенку пищевода и кишки через все слои, после чего однорядный пищеводно-кишечный анастомоз должен быть погружен в кишку так, чтобы был укрыт весь выделенный отдел пищевода. Это создает максимальные условия для сохранения кровообращения и регенерации. После этого приступают к инвагинации. Потягивая за конец нитей-держалок, кишку надвигают на пищевод и завязывают два первых шва, наложенных ранее на заднюю стенку. Далее накладывают аналогичные швы на боковые и переднюю стенку анастомоза. Швы следует накладывать в косом направлении с захватом продольного и циркулярного мышечного слоя пищевода. Формируется межкишечный анастомоз по Ру и анастомозированную с пищеводом петлю тонкой кишки фиксируют отдельными узловыми швами в окне брыжейки поперечной ободочной кишки на уровне межкишечного анастомоза в косом направлении.
Механический шов пищеводно-кишечного анастомоза. Самым трудным и ответственным этапом операции при гастрэктомии пли резекции кардии является создание анастомоза. Трудность анастомозирования при этих операциях обусловлена значительной глубиной раны и узостью угла наклонения оси операционного поля. Высокая летальность при гастрэктомии чаще всего связана с несостоятельностью швов анастомоза. Это побудило хирургов искать лучшие операционные доступы и совершенствовать методы анастомозирования. Разрешение последней проблемы имеет длинную историю. Некоторые виды анастомозов были разработаны экспериментально и не вошли в практику как непригодные. Пластические анастомозы не получили широкого распространения. Можно считать, что в настоящее время большинство хирургов применяют обычный двухрядный шов с укрытием анастомоза, кишечной петлей, отказавшись от сложной техники (рис. 90, 91).
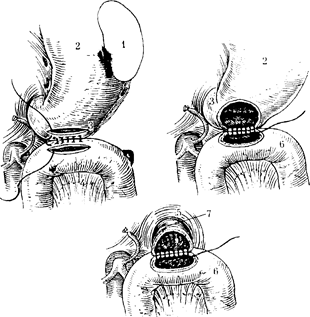
Рис. 90. Этапы наложения пищеводно-кишечного анастомоза.
1 — селезенка; 2 — желудок; 3- пищевод; 4 — брыжейка; 5 -диафрагма; 6 — тощая кишка;
7 — пищевод.
Принцип чем проще, тем лучше здесь себя оправдывает. Хочется особо подчеркнуть, что очень важно при наложении швов анастомоза помнить об особенностях строения стенки
пищевода и питающих его сосудах.
Отдавая дань развитию современной медицинской техники, было бы неправильно не ознакомить практического врача с аппаратом, позволяющим механически сшивать пищевод с кишкой при гастрэктомии и с желудком при резекции кардии. С. И. Бабкиным, Т. В. Афанасьевым, В. С. Касулниым, Т. В. Калининой и др. был сконструирован и изучен в эксперименте аппарат ПКС, предназначенный для сшивания пшге-вода с кишкой скобками из тапталла или кобальта. Шов ложится циркулярно в один ряд. Во время прошпвапия циркулярный нож формирует просвет анастомоза. Аппарат применяется следующим образом (рис. 92). После гастрэктомии и обработки культи двенадцатиперстной кишки подводят тощую кишку к месту предполагаемого соустья. На края пищевода накладывают обвивной шов. На одной из петель в области
будущего межкишечного шва соустья производят продольный разрез длиной 5 см, через который в ее просвет вводят корпус аппарата впритык с участком стенки кишки, где должен быть сформирован анастомоз.
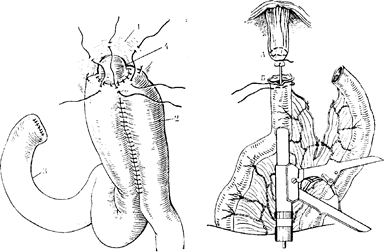
Рис. 91. Гастрэктомия закончена.
1—диафрагма; 2—тощая кишка; 3—двенадцатиперстная кишка; 4—пищевод.
Рис. 92. Наложение пищеводно-кишечного анастомоза с помощью аппарата ПКС-25.
А — пищевод; Б —кишка.
В этом месте кишку прокалывают остроконечным скальпелем и через образованное отверстие вводят шток с головкой. После введения головки в пищ,евод завязывают кисетный шов. Теперь головку и корпус аппарата сближают до полного соприкосновения тканей. Сильным сжатием рукоятки до предела производят сшивание. Аппарат извлекают и накладывают межкишечное соустье. Пищевод и кишку сшивают дополнительными укрывающими швами.
Подобным же образом накладывают анастомоз пищевода с желудком при резекции кардии чрезгрудным доступом. Шток вставляют через временно незашитую часть желудка.
В ОНЦ АМН СССР этот аппарат используется с 1960 г. при гастрэктомиях и резекциях кардии.
Увлечение сшивающим аппаратом ПКС в настоящее время прошло. Опыт ОНЦ АМН СССР, основанный на изучении результатов 200 радикальных операций с применением механического шва, показал, что этот тип анастомоза снижает число осложнений в ближайшие дни после операции, но дает целый ряд серьезных осложнений в отдаленные сроки (рубцовые сужения, рефлюкс-эзофагит), нередко требующих повторных операций.
Гастрэктомия с прямым эзофагодуоденоанастомозом. Еще на заре развития желудочной хирургии некоторые хирурги производили гастрэктомшо с непосредственным соединением пищевода с двенадцатиперстной кишкой (С. II. Федоров, Н. П. Тринклер, Brigham, Richardson, Macdo-nald, и др.). В СССР первая успешная операция этого типа была выполнена в 1910 г. В. М. Зыковым.
Интерес к эзофагодуоденостомии постепенно ослаб, что зависело от нечастой возможности выполнения этой методики, С. С. Юдин, А. В. Мельников, А. Г. Савиных к этой операции относились отрицательно.
Н. II. Блохип разработал метод эзофагодуодепоанастомоза (рис. 93—97), заключающийся в следующем. После выделения желудка производят мобилизацию двенадцатиперстной;
кишки, для чего надсекают брюшину по ее горизонтальной и нисходящей части и путем тупого разделения брюшины создают максимальную подвижность горизонтальной части двенадцатиперстной кишки. Мобилизуют и брюшной отдел пищевода. После иссечения желудка концы пищевода и двенадцатиперстной кишки должны свободно накладываться друг па друга на 3—4 см. Если этого не достигнуто, следует отказаться от эзофагодуоденоанастомоза и наложить соустья между пищеводом и тощей кишкой.
Формирование эзофагодуодепоанастомоза производят следующим образом. Через мышечный слой пищевода и серозно-мышечный слой двенадцатиперстной кишки при их сближении накладывают непрерывный шелковый шов крупными стежками. Они идут параллельно краю пересеченного органа, при этом каждый новый вкол делают как можно ближе к месту предыдущего выкола. При такой технике сшивания каждый шов имеет форму трапеции, так что при подтягивании концов нити происходит одновременно смыкание соединенных стенок и некоторое их растяжение.
Натягивая нить, накладывают циркулярно внутренний кет-гутовый шов на всю толщу пищевода и двенадцатиперстной кишки. Теперь остается наложить непрерывный шов на переднюю стенку анастомоза по описанной выше технике. Следует помнить, что, если первый шов начинался с пищевода и заканчивался на кишке, то второй шов необходимо начать на кишке п кончить на пищеводе. Концы нитей переднего и заднего шва надо натянуть, при этом сразу же уходит, вворачи-ваясь внутрь, линия шва слизистой оболочки, одновременно. концы органов плотно сближаются и вместе с тем расширяют просвет анастомоза. Концы нитей по обе стороны анастомоза связывают друг с другом. При необходимости накладывают несколько дополнительных узловых швов.
Как показал опыт, непрерывный шелковый шов надежно соединяет стенки органов, предупреждая развитие рубцового сужения анастомоза.
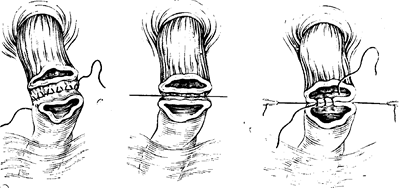
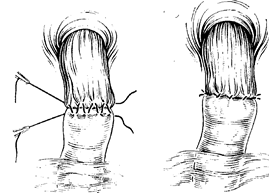
Рис. 93. Шов Н.Н. Блохина наложен на пищевод и двенадцатиперстную кишку.
Рис. 94. Внутренний шов пищевода и двенадцатиперстной кишки.
Рис. 95. Передний шов.
Рис. 96. Задний шов затянут.
Рис. 97. Анастомоз закончен.
Кроме того, он упрощает технику, а следовательно, ускоряет операцию.
В клинике ОНЦ АМН СССР гастрэктомия с прямым эзофа-годуоденоапастомозом при раке желудка по методу Н. Н. Бло-хина была выполнена у 66 больных, причем у части из них было значительное распространение процесса, о чем свидетельствует выполнение комбинированных операций у 25 больных: у 10 больных была дополнительно резецирована поджелудочная железа, у 2— левая доля печени, у 4 — поперечная ободочная кишка, у 8 — брыжейка поперечной ободочной кишки и у одной больной — оба яичника в связи с наличием в них метастазов. После операции умерли 13 больных (19%). Основной причиной летальности была несостоятельность швов анастомоза (11 больных). Прожили 5 лет и более 10 больных, из них 4 прожили 8 лет.
Гастрэктомия с эзофагодуоденоанастомозом проводится в ОНЦ АМН СССР при строго ограниченных показаниях, операция выполняется брюшным доступом; в большинстве случаев без рассечения диафрагмы, но с соблюдением всех онкологических принципов удаления желудка по поводу рака.
Гастрэктомия по Савиных. Операцию начинают с мобилизации левой доли печени, для чего пересекают печс-ночно-диафрагмальную связку. После этого между двумя лигатурами ножницами рассекают нижнюю диафрагмальную пену и на небольшом участке диафрагму. Через образовавшееся отверстие заводят указательный палец, которым отслаивают и отодвигают перикард. После этого диафрагму рассекают дополнительно на 6—8 см, пересекают обе диафрагмальные ножки и оба блуждающих нерва. Благодаря широкой диафрагмо-круротомии образованное в диафрагме отверстие вполне достаточно для мобилизации нижней трети пищевода п наложения соустья в средостении. Освобождение желудка начинают с большой кривизны, вначале в области дна перевязывают короткие сосуды, затем освобождают всю большую кривизну с большим сальником, как было описано выше. Далее производят мобилизацию двенадцатиперстной кишки, ее пересечет к-' и закрытие. После перевязки левой желудочной артерии у ге отхождепия от чревной артерии желудок опорожняют отсосем и помещают под левый купол диафрагмы, чем создают лучший простор для формирования соустья.
Провпзорно выше и ниже предполагаемого анастомоза пищевод перевязывают марлевыми полосками. Петлю тощей кишки для анастомоза проводят через отверстие в брыжейке поперечной ободочной кишки. На участке, предназначенном для апа-стомозирования, делают поперечный разрез через все слон и тут же его зашивают непрерывным швом. На кишку н правую боковую поверхность пищевода накладывают первый ряд швов, после чего рассекают пищевод и снимают шов, наложенный ранее для предотвращения вытекания кишечного содержимого. Затем накладывают второй ряд швов на стенку пищевода и кишки. Переднюю стенку анастомоза также сшивают двухрядным швом. Линию швов анастомоза прикрывают приводящей петлей, фиксированной швами к пищеводу и диафрагме. При высоком сечении пищевода эзофагоеюноапасто-моз А. Г. Савиных помещал в средостение без добавочного укрытия. Межкишечным соустьем закапчиваются основные этапы гастрэктомии по этому методу.
Экстирпация резецированного желудка. При раке резецированного желудка выбор оперативного доступа диктуется теми же соображениями, что н при раке неопсриро-ванпого желудка. Применяют два основных доступа: чрезбрто-шинпый показан при опухолях без перехода на абдоминальный отдел пищевода, комбинированный начинается с лапаро-томии, ревизии, мобилизации остатка резецированного желудка с анастомозом и пищевода. Затем выполняют торакотомию, мобилизацию нижнегрудного отдела пищевода, удаление препарата и формирование пищеводно-кишечного анастомоза. Чисто чресплевральный доступ при этих операциях применяется редко пз-за трудности выяснения операбельности в связи с обширным спаечным процессом. В ряде случаев при чрезбрю-шпнттом доступе и переходе опухоли на пищевод операция мо-жег быть выполнена по методу А. Г. Савиных.
По вскрытии брюшной полости сразу же возникают значительные трудности, так как обширные рубцовые сращения париетальной брюшины с сальником, поперечной ободочной кишкой и печенью создают условия, при которых проникновение в свободную брюшную полость сопряжено с определенными сложностями, а порой и опасностью. Для предотвращения повреждения полого органа, возникновения кровотечения не следует вскрывать брюшину там, где она наиболее рубцово изменена. С этой целью конец после рассечения отсепаровы-вают в стороны, обнажают передний листок апоневроза прямых мышц живота и рассекают его в продольном направлении, тупо расслаивают мышцу и, манипулируя тугим тупфером, обнажают париетальную брюшину.
После того, как обнаружен участок брюшины, свободный от сращений, вскрывают брюшную полость. Далее частично тупым путем отделяют припаянные петли кишок до тех пор, пока весь конгломерат не окажется свободным от париетальной брюшины, со всех сторон. И только после этого появляется возможность ревизии органов брюшной полости, при которой необходимо основное внимание обратить на два момента:
распространенность опухолевого процесса (наличие метастазов и прорастания опухоли в окружающие органы) и технические детали первой операции. Повторные операции на желудке после резекции по Бильрот I технически наиболее просты, в отличие от резекции по Бильрот II. При наличии поза-диободочного анастомоза на короткой петле после экстирпации остатка резецированного желудка остается небольшой участок приводящей петли, который в дальнейшем используют для формирования межкишечного анастомоза. В ряде случаев в связи с недостаточной длиной этого участка приходится рассекать париетальную брюшину и мобилизовывать нижнегоризонтальную часть двенадцатиперстной кишки. При выделении желудочно-кишечного анастомоза, фиксированного в окне ме-зоколон, могут быть повреждены сосуды брыжейки поперечной ободочной кишки с нарушением ее питания. При рецидивной опухоли в области анастомоза, фиксированного в окне мезоко-лон, при выделении повреждаются сосуды кишки и хирург вынужден производить резекцию поперечной ободочной кишки. При впередиободочном анастомозе эти опасности встречаются реже. Выделение анастомоза из спаек— ответственный момент, требующий предельной осторожности. Лучше всего манипули
 ровать тупфером или пальцем, рассекая рыхлые сращения. Более ттлотпые сращения необходимо пересекать отдельными порциями, ни в косм случае не беря их на зажимы. Перевязывать нужно только кровоточащие сосуды. Целесообразно сохранить участок брыжейки шириной 2—3 см вдоль края кишки. После выделения анастомоза кишку осматривают и опускают. Вторично осматривают ее в конце операции, решая вопрос о состоянии кровоснабжения.
ровать тупфером или пальцем, рассекая рыхлые сращения. Более ттлотпые сращения необходимо пересекать отдельными порциями, ни в косм случае не беря их на зажимы. Перевязывать нужно только кровоточащие сосуды. Целесообразно сохранить участок брыжейки шириной 2—3 см вдоль края кишки. После выделения анастомоза кишку осматривают и опускают. Вторично осматривают ее в конце операции, решая вопрос о состоянии кровоснабжения.
Следующий этап операции — мобилизация остатка резецированного желудка по большой и малой кривизне. При наличии узлов в области ворот селезенки целесообразно производить спленэктомию единым блоком с желудком.
Рис. 98. Наложение пищеводно-кишечного анастомоза по методу Березкина — Цацаниди (начало).
Довольно часто при мобилизации желудка по большой кривизне происходит травма селезенки, требующая ее удаления. Мобилизация желудка по малой кривизне осуществляется путем отсечения остатков малого сальника от печени. Последним этапом является мобилизация пищевода. При раке, не переходящем иа пищевод, производят мобилизацию левой доли печени, рассекают переходную складку брюшины спереди от пищевода и отодвигают брюшину кверху по пищеводу, после чего становится хорошо видим левый блуждающий нерв, который пересекают. На задней стенке отыскивают правый блуждающий нерв, который также пересекают. При переходе опухоли па пищевод можно выполнить операцию Савиных или заключительный этап операции произвести из трансторакального доступа. В зависимости от типа опухолевого роста производят пересечение пищевода от макроскопически определяемой границы опухоли. Конечный этап операции — формирование пище-водпо-кишечного соустья — не отличается от таковых при гастрэктомии. Лучшим методом анастомоза следует считать инвагинационный по Березкину—Цацаниди (рис. 98—100). Межкишечный анастомоз накладывают, как правило, по Ру.
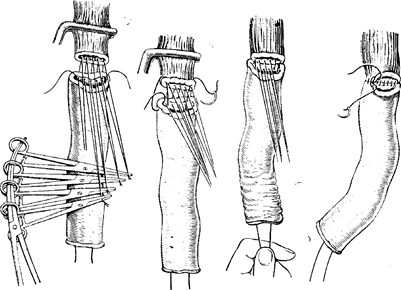
Рис. 99. Этапы наложения швов (продолжение).
Паллиативные операции.
Эти операции разделяются на три основные группы:
1) паллиативные резекции желудка;
2)обходные анастомозы (гастроэнтеро-, эзофагоеюно-, эзофаго-фундоанастомозы);
3) питательные свищи (гастростома, еюно-стома).
Паллиативные резекции желудка позволяют удалить первичную опухоль и избавить больного от опухоли и ее осложнений. Дистальная паллиативная резекция применяется нередко, а паллиативная гастрэктомия или проксимальная резекция как операции с повышенным риском применяться не должны.
Хирургическая техника паллиативной резекции такая же, как при радикальном вмешательстве. Как правило, резецируют 2/3 желудка, а иногда и меньше. В случае невозможности выполнения паллиативной резекции при стенозирующем раке выходного отдела желудка следует наложить гастроэнтероана-стомоз.
Чаще всего применяют два типа этой операции: впередиобо-дочной гастроэнтероанастомоз на длинной петле с брауповским межкишечным соустьем, который накладывают на переднюю, свободную от опухоли стенку желудка, и позадиободочный, накладываемый на заднюю, свободную от опухоли стенку желудка без межкишечного анастомоза. При раке проксималь Ного отдела желудка с дисфагией возможно применение гастростомии (рис.101).
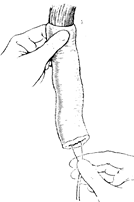
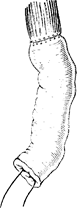
Рис. 100. Анастомоз закончен.
Еюностомия по Майдлю (рис. 102) показана при тяжелой непроходимости пищевода и кардии и особенно при раке резецированного желудка, когда пет скободпой от опухоли стенки желудка для наложения гастростомы. При этой операции производится ворхиесрединная лапаротомия. Выбирают петлю тонкой кишки, отступая на 25—30 см от трейцевой связки с таким расчетом, чтобы можно было бы провести петлю в подкожном туннеле, расположенном на 10—12 см выше реберной дуги слева. Петлто на предполагаемом уровне пересекают и проводят под кожей выше реберной дуги на 10—12 см, а затем через дополнительный разрез выводят и фиксируют к коже узловыми швами. Непрерывность пищеварительного тракта восстанавливается межкишечпым анастомозом по Ру. Выведенный на кожу грудной стенки конец топкой кишки можно прижать пелотом, бандажом, что препятствует вытеканию кишечного содержимого и мацерации кожи.
Паллиативные операции выполняются тогда, когда риск их невелик. В связи с этим оптимальными являются паллиативные резекции 2/3 или 3/4 желудка, направленные на удаление стсиозирующой опухоли выходного отдела желудка, распадающейся и кровоточащей опухоли как источника кровотечения, угрожающего жизни и т. д. При невозможности выполнения паллиативной резекции применяют операции меньшего объема: гастроэнтероанастомоз при стенозирующем раке выходного отдела желудка или различного рода питательные свищи — гастростому и еюностому (предпочтительнее в модификации Майдля).

Рис. 101. Гастростома.
А — по Кадеру (а, б, в);
Б — по Витцелю.
При проксимальном раке. когда дисфагия выражена незначительно, еюностому по Майдлю можно наложить «про запас», т. е. вывести слепой конец кишки под кожу грудной стенки выше реберной дуги, вскрыв ее в случае полной непроходимости. Эзофагоеюноанастомоз или интубация кардии при раке проксимального отдела желудка как тяжелые вмешательства применяться не должны. Паллиативные операции значительно не удлиняют жизни больных, но избавляют их
Ри.с. 102. Еюностомия по Майдлю.
от страданий и тягостных симптомов. В ряде случаев в последующем эти операции могут быть дополнены химиотерапией.
Послеоперационная летальность и осложнения.
Послеоперационная летальность в последние годы значительно снизилась. Так, по данным А. С. Лурье (1974), общая послеоперационная летальность составляет 13,7%, после дистальных резекций по Бильрот II—7,1%, по Бильрот I— 1,3%, после резекции кардии и пищевода—20,9%, после чрезбртошинных гастрэктомий— 12,9%, чресплевральных— 26,2%. По сводной статистике па 4657 гастрэктомий летальность составила 15,2%, а на 2645 проксималышх резекций— 14,7% (В. С. Маят, Ю. М. Панцырев, Ю. В. Дульцев, В. П. Белов, 1967). По данным Б. Е. Петерсона (1972), общая послеоперационная летальность после проксимальной резекции желудка и гастрэктомий составила 20,2%. Основной причиной смерти в послеоперационном периоде следует считать недостаточность швов анастомоза.
Недостаточность швов анастомоза (пищеводно-кишечного и желудочно-кишечного) встречается у 26,8—31,7% больных и является самым частым осложнением после гастрэктомий и проксимальной резекции желудка, приводящим к развитию перитонита и эмпиемы плевры и летальному исходу (Б. Е. Петерсон, 1972; А. И. Саенко, 1973). Недостаточность швов желудочно-кишечного анастомоза после субтотальной дистальной резекции явление нечастое. Главной причиной развития недостаточности следует считать дефекты оперативной техники.
Факторы, снижающие регенераторные способности тканей, также способствуют возникновению этого осложнения. Поэтому у пожилых и ослабленных больных это осложнение встречается чаще. Недостаточность швов анастомоза развивается в ранние (первые 4—7 дней) и значительно реже в более поздние сроки (на 15—20-й день после операции). Рано возникшая недостаточность всегда более опасна. В картине крови преобладает лейкоцитоз с резким сдвигом влево, анэозинофплия. По дренажу вытекает кишечное или желудочное содержимое, развивается картина перитонита или медиастинита. Лечебная тактика в таких случаях должна быть последовательной и консервативной. Прежде всего мы прибегаем к раннему рентгенологическому исследованию анастомоза на 5—7-е сутки после операции. Это позволяет получить точные сведения о состоянии анастомоза и характере осложнений; выявляет наличие и локализацию дефекта в анастомозе, глубину затекания контрастного вещества за пределы анастомоза. Ранняя диагностика этого осложнения дает возможность в последующем излечить некоторых больных.
Прогноз гораздо лучше, когда недостаточность ограничена и нет затеков. При наличии затеков прогноз гораздо хуже.. В этих случаях повторная операция показана только тогда, когда необходимо вскрыть образовавшиеся гнойные затеки. В последние годы в лечении недостаточпости швов анастомоза с пищеводом мы применяем фиброэзофагоскопию (Б. К. Поддубный, 1977) для установления локализации дефекта, его размеров, а также для аспирации содержимого из затеков через дефект в апастомозе и систематического промывания полостей лекарственными средствами. Эти меры в сочетании с консервативной терапией дают надежду на излечение. Консервативная терапия складывается из парентерального питания, включающего переливания свежей кровп и кровезамещающих жидкостей, введения растворов электролитов и глюкозы (до 2 л), аминозола (10% раствор) и интралипида (10—20% раствор) по 500 мл. Некоторые наши больные находились па парентеральном питании в течение 30—45 дней. Больных, которые не переносят длительного парентерального питания, можно кормить обычным способом, пища должна содержать значительное количество обволакивающих средств, но обязательно лежа и в таком положении, чтобы дефект в анастомозе находился наверху. При птом обязательно через день производить отсасывание содержимого из затеков с помощью фиброэзофа-госкопа. Подобная тактика позволила нам вылечить 20 больных из 33 наблюдавшихся за последние 4 года (В. П. Куласв-ская. 1975).
Причиной перитонита после дпстальпых резекций желудка может быть недостаточность швов желудочно-кишечного анастомоза, культи двенадцатиперстной кишки, межкигаечного
-анастомоза и т. п., что связано с техническими погрешностями so время операции, истощением, гипопротеинемией и т. д.
Среди гнойных осложнений, не связанных с нарушением герметичности швов анастомоза, наиболее тяжелыми следует считать поддиафрагмальные абсцессы и перитонит. Основная. причина развития поддиафрагмального абсцесса—нагноение сгустков крови, скопляющейся под диафрагмой п между кишечными петлями, в результате инфицирования во время операции (из раны и из вскрытых лимфатических путей при инфицированной опухоли). Для предупреждения этого осложнения пообходимо провести тщательную ревизию брюшной полости после операции и удалить все сгустки крови. При выявлении ноддиафрагмального, межкишечного и других абсцессов показано оперативное вмешательство с дренированием полости гнойника. При отсутствии адекватного лечения все гнойные осложнения приводят к развитию ограниченного, а затем и разлитого перитонита. Выявление перитонита является абсолютным показанием к повторной операции, целью которой является отграничение патологического очага от свободной брюшной полости и дренирование. При разлитом перитоните, после установления причины его, необходимо дренировать латеральные каналы, оставить микроирригаторы для введения антибиотиков с учетом флоры, а в первые 24—48 ч целесообразно проведение перитонеалыюго диализа.
К_ранним послеоперационным осложнениям относится ана-стомозпт, который обусловлен в основном ошибками в технике наложения анастомоза: узостью анастомоза и значительным отеком тканей в послеоперационном периоде. При формировании анастомоза по Бильрот II, когда имеется несоответствие отверстий, образуется грубый гофрирующий шов с избытком тканей, которые вворачиваются в просвет и нарушают проходимость анастомоза. Применение противовоспалительной терапии с обязательной эвакуацией содержимого из желудка на фоне парентерального питания приводит к стиханию явлений апастомозита. Лучшим видом лечения анастомозитов является промывание желудка настоем ромашки при одновременном назначении антибиотиков. Помощь оказывает противовоспалительная рентгенотерапия. Если в течение 10—14 дней не удается ликвидировать анастомозит, необходимо повторно оперировать. Это единственный шанс на спасение.
Эзофагит чаще возникает при пищеводно-кишечных и пище водно-желудочных соустьях. Причиной его является забрасывание в пищевод желчи, обусловленное удалением кардк-альттого жома и перерезкой блуждающих нервов, ведущей к трофическим расстройствам. Эзофагит наблюдается реже при анастомозе пищевода с длинной кишечной петлей конец в бок (операция Орра — Ханта — Накаямы) с межкишечным соустьем по Ру. При послеоперационном эзофагите главной лечебной мерой является диета. Она должна быть механически щадящей п вместе с тем полноценной, состоять из жидких, полужидких и желеобразных блюд. Перед едой необходимо назначать по 1 столовой ложке растительного масла, целесообразно также давать 0,25—0,5% раствор новокаина и аитиспа-стические средства,
Послеоперационный период. У большинства больных раком желудка имеются нарушения со стороны водно-солевого, белкового и других видов обмена. Более половины больных— это лица в возрасте 60 лет и старше с сопутствующими заболеваниями сердечно-сосудистой системы, органов дыхания, печени, которые отмечаются почти у 80% больных, Тяжесть послеоперационного течения определяется совокупностью факторов, которые зависят от характера и объема оперативного вмешательства, стадии опухолевого процесса, возраста и состояния больного, наличием различного рода сопутствующих заболеваний. Поэтому в послеоперационном периоде необходимо обеспечить достаточное обезболивание (особенно в первые сутки), которое предупреждает развитие болевого шока и способствует быстрому восстановлению нормальных функций; 2) профилактику и лечение осложнений со стороны сердечнососудистой и дыхательной систем; 3) полноценное парентеральное питание, корригирующее нарушение белкового, минерального обменов и способствующее улучшению регенераци-онных способностей оперированных тканей; 4) профилактику тромбоэмболии.
Значительное место в комплексе обезболивающих мероприятий имеет перидуральная анестезия, широко применяемая в ОНЦ АМН СССР.
Достаточно широко применяются лечебный наркоз по методике Б. В. Петровского и С. И. Ефуни, препараты опия и нх синтетические заменители в комбинации с препаратами фено-тиазинового ряда. Важным моментом послеоперационного периода, особенно у больных, оперированных трансторакальным доступом, является активная аспирация плеврального содержимого с помощью отсасывающего устройства. Это мера способствует раннему расправлению легкого и устраняет необходимость плевральной пункции. Помимо этого, постоянный дренаж позволяет до некоторой степени контролировать степень и интенсивность геморрагии и служит контролем заживления анастомоза. В случае возникновения недостаточности швов анастомоза с пищеводом образуется св
 2020-09-24
2020-09-24 116
116








