ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
 |
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей и технической физики
Лаборатория виртуальных экспериментов
ЛАБОРАТОРНАЯ РАБОТА №6
Физика. Определение теплоемкости твердых тел
Методические указания к лабораторной работе
С использованием компьютерных технологий
САНКТ-ПЕТЕРБУРГ 2019
Введение
В процессе обучения в вузе выполнение лабораторной работы студентами является одной из форм образовательных технологий. Она способствует формированию у студентов комплекса компетенций, таких как: способность к познавательной и творческой деятельности; способность использовать навыки работы с информацией из различных источников для решения профессиональных задач и др.
Методические указания к лабораторной работе предназначены для самостоятельной работы студентов. Они содержат основные теоретические сведения по теме, а также порядок выполнения и оформления лабораторной работы.
При выполнении лабораторной работы, студент должен понимать физический смыл данного явления или процесса рассматриваемого в лабораторной работе. Поэтому к выполнению работы целесообразно приступать только после изучения теоретического и методического материала, соответствующего данному разделу.
Кроме формирования необходимых для выпускников вуза компетенций, самостоятельное выполнение лабораторной работы способствует подготовке студентов к сдаче экзамена.
Краткое теоретическое содержание
Теплоёмкость
Теплоемкостью тела называется величина, определяемая количеством теплоты, необходимым для нагревания тела на 1° К
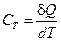 (1)
(1)
т.е. отношение бесконечно малого количества теплоты δ Q (δ Q не является полным дифференциалом), полученного телом, к соответствующему приращению его температуры dT.
Теплоёмкость, отнесённая к единице массы вещества, называется удельной теплоёмкостью
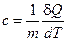 (2)
(2)
Теплоёмкость, отнесённая к одному молю вещества, называется молярной теплоёмкостью
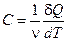 (3)
(3)
где m и ν – масса и число молей вещества.
Удельная и молярная теплоёмкости характеризуют уже не данное тело, а вещество, из которого тело состоит. Между вышеуказанными теплоёмкостями существуют очевидные соотношения
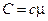 , (4)
, (4)
где μ – молярная масса вещества (численно равная массе моля).
Первое начало термодинамики в дифференциальной форме
δ Q = dU+ δ А
где dU – бесконечно малое изменение внутренней энергии системы, δ А – элементарная работа, δ Q – бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а δ Q и δ А таковыми не являются.
Если нагревание происходит в условиях, когда объём остается постоянным (V = const), то соответствующая молярная теплоёмкость называется теплоёмкостью при постоянном объёме, или изохорической теплоёмкостью, и обозначается 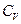
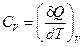 . (5)
. (5)
Так как теплота при этом тратится только на изменение внутренней энергии dU, то δ Q = dU и
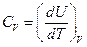 . (6)
. (6)
Отсюда dU = CV dT и первое начало термодинамики можно записать как
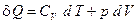 . (7)
. (7)
Следовательно, подводимое к телу тепло расходуется на изменение температуры dT (изменение внутренней энергии) и изменение объёма dV.
Если при нагревании постоянным остаётся давление, то теплоёмкость называется теплоёмкостью при постоянном давлении СP, или изобарической теплоёмкостью
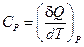 (8)
(8)
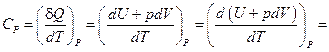
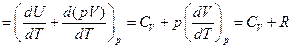 . (9)
. (9)
Теплоёмкость твердых тел
В твердых телах частицы вещества «закреплены» в определённых положениях равновесия, отвечающих минимуму энергии взаимодействия их друг с другом. Основной формой движения, доступной таким частицам, являются колебания около положений равновесия, называемых узлами кристаллической решётки. Амплитуда этих колебаний составляет незначительную долю расстояния между атомами (≈0,05 r 0). Рассмотрим основные теории теплоёмкости твёрдых тел.
В основе классической теории теплоёмкости твёрдых тел (кристаллов) лежит закон равнораспределения энергии по степеням свободы. Твёрдое тело рассматривается как система N независимых друг от друга атомов, имеющих по три колебательных степени свободы. Атомы совершают тепловые колебания около положений равновесия, и если они малы, то их можно рассматривать как гармонические. На каждую степень свободы приходится в среднем энергия kT (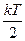 в виде кинетической и
в виде кинетической и 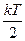 в виде потенциальной, k – постоянная Больцмана, T – абсолютная температура тела). Таким образом, значение полной энергии, приходящейся на одну колебательную степень свободы, равно
в виде потенциальной, k – постоянная Больцмана, T – абсолютная температура тела). Таким образом, значение полной энергии, приходящейся на одну колебательную степень свободы, равно
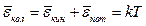 . (10)
. (10)
Имея в виду, что число степеней свободы многоатомных газов 3 N – 6, (где N – число молекул, 6 – число степеней свободы поступательного и вращательного движения), то число колебательных степеней свободы равно 3 N, получим, что внутренняя энергия одного моля атомов U =3 NA kT =3 RT, где NA – число Авогадро, R=kNA – универсальная газовая постоянная. Отсюда молярная теплоёмкость твёрдого тела
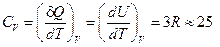
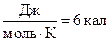 (11)
(11)
Согласно (2.11) молярная теплоёмкость всех химических простых кристаллических твёрдых тел одинакова и равна 3 R. Этот закон был установлен экспериментально Дюлонгом и Пти. Из него следует, что молярная теплоёмкость не должна зависеть ни от свойств вещества из которого состоит кристалл, ни от температуры.
Однако опыты показывают, что при обычных температурах молярная теплоёмкость большинства твёрдых тел (химических элементов) близка к значению 3 R и почти не зависит от температуры, но при низких температурах теплоёмкость убывает (рис.2.1), стремясь к нулю при 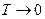 по закону CV ~ T 3.
по закону CV ~ T 3.
Причиной расхождения классической теории теплоёмкости является ограниченность применения закона равномерного распределения энергии теплового движения по степеням свободы. Наблюдаемая на опыте зависимость теплоёмкости от температуры может быть объяснена на основе квантовых представлений.
Модель Эйнштейна
В теории Эйнштейна твердое тело рассматривалось как система N атомов, каждый из которых является квантовым гармоническим осциллятором. Предполагалось, что колебания атомов происходят независимо друг от друга с одинаковой частотой ν. Энергия квантового гармонического осциллятора дискретна
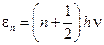 , n = 0, 1, 2..., (12)
, n = 0, 1, 2..., (12)
где h – постоянная Планка.
Согласно теории Эйнштейна молярная теплоёмкость кристаллической решётки определяется как
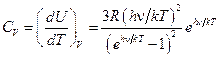 . (13)
. (13)
При высоких температурах (kT >>h ν) выражение (13) переходит в (11), при низких температурах (kT << h ν) 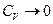 . Однако по теории Эйнштейна зависимость CV (T) имеет экспоненциальный характер при
. Однако по теории Эйнштейна зависимость CV (T) имеет экспоненциальный характер при 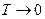 , опыт даёт, что CV ~ T 3. Эти расхождения связаны с чрезмерным упрощением самой модели твёрдого тела – с предположением, что все атомы колеблются независимы друг от друга и с одинаковой частотой.
, опыт даёт, что CV ~ T 3. Эти расхождения связаны с чрезмерным упрощением самой модели твёрдого тела – с предположением, что все атомы колеблются независимы друг от друга и с одинаковой частотой.
Модель Дебая
В этой модели кристаллическая решётка рассматривается как связанная система взаимодействующих атомов. Колебания такой системы – результат наложения многих гармонических колебаний с различными частотами. Под гармоническим осциллятором той или и иной частоты теперь надо понимать колебания не отдельного атома, а всей системы в целом. Задача сводится к нахождению спектра частот этих осцилляторов. Это весьма сложно. Дебай сильно упростил задачу. Он обратил внимание на то, что при низких температурах основной вклад в теплоёмкость вносят колебания низких частот, которым соответствует малые кванты энергии h ν. Низкочастотный же спектр колебаний решётки может быть рассчитан достаточно точно.
| CV, Дж/(мольК) | 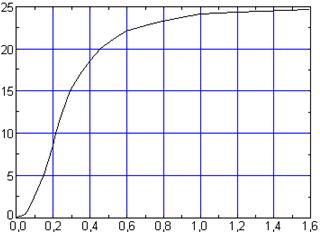 |
| T /Θ |
Рис. 1. Зависимость CV (T) твердых тел от приведенной температуры T /Θ
Теория Дебая теплоёмкости твёрдых тел хорошо согласуется с опытом при низких температурах (при 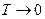 действительно CV ~ T 3).
действительно CV ~ T 3).
Для высоких температур (T >>Θ) теория Дебая приводит к закону Дюлонга и Пти, где
Θ – называется характеристической температурой Дебая, и определяется из условия
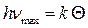 . (14)
. (14)
Согласно теории Дебая теплоёмкость определяется
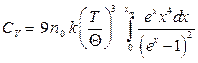 , (15)
, (15)
где 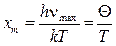 ,
,
νmax – верхняя граница возможных частот колебаний. Дебаевская температура Θуказывает для каждого твёрдого тела область температур (T< Θ), где становится существенным квантование энергии колебаний. Соотношение (15) не является универсальным, т.к. оно хорошо передаёт зависимость CV (T) только для химически простых тел с простой кристаллической решёткой. К телам с более сложной структурой формула Дебая не применима. Это связано с тем, что у таких тел спектр колебаний оказывается очень сложным.
 2020-09-24
2020-09-24 1042
1042







