Простейшей идеализированной моделью вещества является идеальный газ.
Идеальный газ - этогаз, в котором взаимодействие между молекулами пренебрежимо мало, а размеры молекул много меньше размеров сосуда.
Для описания сложной системы (термодинамической системы), состоящей из большого числа молекул, используют усреднённые параметры системы. Основные из этих параметров - объём, давление и температура.
Уравнение состояния – функциональная зависимость между параметрами состояния при равновесии.
Общий вид уравнения состояния термодинамической системы
F (P, V, T) = 0. (1)
Конкретный вид уравнения зависит от физических свойств рассматриваемой системы. Большинство газов при нормальных условиях с достаточной точностью могут быть описаны уравнением состояния идеального газа.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
 или
или 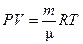 . (2)
. (2)
где R – универсальная газовая постоянная, R = 8,31 Дж / (моль×К);  – количество вещества; m – масса газа;
– количество вещества; m – масса газа; 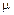 – молярная масса газа.
– молярная масса газа.
Универсальная газовая постоянная это физическая величина, характеризующая работу одного моля газа при его изобарном нагревании на один Кельвин.
Другая форма уравнения состояния
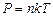 . (3)
. (3)
где Т – термодинамическая температура, k –постоянная Больцмана, k = 1,38·10-23Дж/К.
Все законы идеальных газов для изопроцессов могут быть получены из уравнения состояния идеального газа.
Таблица 1
Частные случаи уравнения состояния идеального газа
| Процесс | Изобарный | Изохорный | Изотермический |
| Закон | Гей-Люссака | Шарля | Бойля-Мариотта |
| Признак | р = const | V = const | Т = const |
| Запись | 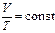
| 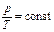
| pV = const |
ТЕПЛОЕМКОСТЬ
Теплоемкостью системы тел (тела) называется физическая величина, характеризующая количество теплоты которое нужно затратить для изменения температуры системы тел (тела) на один Кельвин.
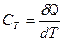 , [ CТ ] = Дж/K. (4)
, [ CТ ] = Дж/K. (4)
Удельной теплоёмкостью вещества с называется скалярная физическая величина, характеризующая количество теплоты, которое нужно затратить для изменения температуры одного килограмма однородного тела на один Кельвин.
 , [ с ] = Дж∙кг–1∙К–1 (5)
, [ с ] = Дж∙кг–1∙К–1 (5)
Молярной теплоёмкостью называется скалярная физическая величина, характеризующая количество теплоты, которое нужно затратить для изменения температуры одного моля веществана один Кельвин.
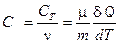 ,[ С ] = Дж·моль–1∙К–1. (6)
,[ С ] = Дж·моль–1∙К–1. (6)
Количество теплоты и значения теплоемкостей зависят от типа процесса. Если теплообмен происходит при постоянном давлении (изобарный процесс) или постоянном объеме (изохорный процесс), то разность соответствующих молярных теплоемкостей СP и СV определяется уравнением Майера.
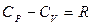 . (7)
. (7)
ПОЛИТРОПНЫЙ ПРОЦЕСС
Политропным называется термодинамический процесс, при котором теплоемкость тела остаётся постоянной
 .
.
Показатель политропы
 , (8)
, (8)
где СP и СV – молярные теплоёмкости тела при постоянном давлении и постоянном объеме.
Уравнение политропы
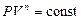 , (9)
, (9)
где п – показатель политропы.
Частными случаями политропного процесса являются все изопроцессы и адиабатический процесс (табл. 2).
Таблица 2
Частные случаи политропного процесса
| Процесс | Показатель политропы n |
| Изобарический | 0 |
| Изотермический | 1 |
| Изохорический | ∞ |
| Адиабатический | g |
 2020-09-24
2020-09-24 137
137








