Вопрос
Предмет химии. Научные методы познания веществ и химических явлений. Роль эксперимента и теории в химии. Химия – одна из фундаментальных естественных наук, знание которой необходимо для плодотворной творческой современного представителя любой специальности. Качество химических знаний приобретает особо важное значение в связи с необходимостью уменьшения энергозатрат, использования новых материалов и повышения надежности современной техники. Понимание химических законов помогает в решении экологических проблем. Изучение химии является частью задачи по формированию мировоззрения Человека.
Основной закон природы – закон вечности материи и ее движения. Химия изучает материальный мир и химическую форму движения материи.
Что же есть материя?
«Материя – есть философская категория для обозначения объективной реальности, которая дана человеку в ощущениях, которая копируется, фотографируется, отображается нашими ощущениями, существуя независимо от них». (В. И. Ленин). Материя первична, а сознание вторично. Движение – основная форма существования материи. Условно различают следующие формы движения материи:
– механическая – физическая – химическая – биологическая
Известны две формы существования материи: вещество и поле. Вещество – материальное образование, состоящее из материальных частиц, имеющих собственную массу. Поле – материальная среда, в которой осуществляется взаимодействие частиц.
Химия изучает первую форму существования материи – вещество. Химия – наука о превращении веществ. Изучает состав и строение веществ, зависимость свойств веществ от их состава, строение и пути превращения одних веществ в другие. Явления, при которых из одних веществ образуются другие, называются химическими.
В развитии химии можно условно выделить следующие периоды:
I. Донаучная химия 1. Древняя атомистика (Левкипп, Демокрит) 2. Практическая и ремесленная химия 3. Алхимия. Открыто много новых веществ (в поисках «философского» камня) и методов очистки.
II. XVI век 1. Иатрохимия (врачебная химия) Парацельс, Агрикола 2. Теория «Флогистона» 1700 г. (Шталь) – особого вещества, удаляющегося при горении из соединений. 3. Аналитическая и пневматическая химия. Р. Бойль (XVII в.). 4. Химическая атомистика – (Дальтон, Бойль, Блэк, Пристли, Лавуазье).
III. Химическая революция 1748 г. – начало химии как науки. 1. Атомно-молекулярное учение М.В. Ломоносова. 2. Периодический закон и периодическая система элементов (1896 г.) Д.И. Менделеев.
Роль эксперимента и теории в химии. Моделирование химических процессов
Прежде чем приступить к любой работе и получить определённый результат, человек выбирает наиболее эффективные и доступные способы и приёмы выполнения её, инструмент и приспособления, которые можно использовать для этого, операции, которые необходимо совершить.
Различают 2 уровня научного познания: эмпирический (т.е. знания, полученные в результате опыта, опытного знания) и теоретический(познание сущности явлений, их внутренних связей).
Метод — это способ достижения какой-нибудь цели, решения конкретной задачи.
Есть методы, которые являются общими для всех наук. В то же время для каждой науки характерны свои методы.
Общенаучные методы: наблюдение, эксперимент, моделирование, прогнозирование.
Химические методы: химический эксперимент, анализ и синтез веществ.
Наблюдение — это способ получения информации путём прямой и непосредственной регистрации событий и условий их протекания.
Наблюдение — это начальный метод познания, позволяющий получить информацию об объекте. Наблюдение является целенаправленным и планомерным методом: оно ведётся для решения заранее поставленных задач, строго по составленному исследователем плану, согласованному с поставленными задачами. Результаты наблюдений фиксируются в виде описания признаков наблюдаемого объекта, таблиц, схем и т. д.
Наблюдения могут быть непосредственными, воспринимаемыми органами чувств человека, и опосредованными, которые проводятся с использованием приборов: микроскопов, телескопов и др.
Эксперимент — это метод исследования явления в определённых условиях. Это более сложный метод познания по сравнению с наблюдением. Он отличается тем, что в ходе эксперимента исследователь может изменять условия (давление, температуру, напряжение и т. д.), устранять побочные факторы. Эксперимент может повторяться несколько раз для получения наиболее достоверных результатов.
Моделирование — процесс исследования реального мира с помощью создания абстрактных, графических и математических моделей.
Моделирование основано на изучении модели. Модель строится по подобию оригинала, на ней воспроизводят свойственные оригиналу процессы, и полученные сведения переносятся на моделируемый объект — оригинал.
Пример:
в химии широко используются модели молекул, которые помогают понять их строение.
Прогнозирование — научно обоснованное предсказание развития событий или явлений на будущее на основе исследований.
Анализ — разделение объекта (мысленно или реально) на составные части с целью изучения их по отдельности.
Анализ позволяет изучить отдельные элементы объекта.
Синтез — соединение составных частей объекта с целью изучения его как единого целого.
Для изучения объекта как единого целого необходимо рассматривать его составные части в совокупности, в единстве. В процессе синтеза производится соединение воедино составных частей изучаемого объекта.
Анализ и синтез лишь в своем единстве дают полное и всестороннее знание действительности.
2. Правила безопасности. Правила работы в лаборатории
Теория:
1. Следует проводить опыты лишь с теми веществами, которые указаны учителем.
2. Приступать к выполнению опыта можно только после усвоения этапов его проведения.
3. Для проведения реакции надо использовать столько вещества, сколько указано в описании опыта. Если количество вещества не указано, то используют 1–2 мл раствора.
4. При нагревании пробирки с жидкостью её надо держать так, чтобы горлышко было направлено в сторону и от себя, и от соседей по парте.
5. Нельзя зажигать спиртовку от другой горящей спиртовки. После завершения нагревания спиртовку гасят, закрыв её колпачком.
6. Нельзя пробовать вещества на вкус.
7. Не разрешается притрагиваться к веществам руками. Взять необходимое количество вещества можно специальной ложечкой или пробиркой.
8. При определении запаха веществ нельзя подносить сосуд близко к лицу, потому что вдыхание паров может вызвать раздражение дыхательных путей.

9. В кабинете химии нельзя пить и есть.
10. Банки и склянки надо закрывать теми же крышками и пробками, какими они были закрыты изначально. Пробки от склянок следует размещать на столе только сухой стороной.
11. При попадании веществ на кожу их надо немедленно смыть большим количеством воды.
12. После завершения работы надо привести рабочее место в порядок и вымыть руки.
Вопрос Состав вещества. Химические элементы. Способы существования химических элементов: атомы, молекулы, ионы. Простые и сложные вещества. Классификация, состав и названия важнейших оксидов, кислот, оснований, солей. Вещества постоянного и переменного состава.
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Молекулой называют наименьшую электронейтральную частицу вещества, способную к самостоятельному существованию и обладающую его химическими свойствами. Молекула представляет собой систему взаимодействующих между собой атомов, образующих определённую структуру с помощью химических связей.
Химический элемент — совокупность атомов, характеризующихся одинаковым значением (величиной) заряда ядра. (Сейчас известно 115 хим. Элементов)
Ионами называют электрически заряженные частицы, возникающие при потере или присоединении электронов атомами или молекулами.
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
Вещество — любая совокупность атомов и молекул.
Свойства веществ (температуры плавления и кипения, плотность, цвет и т. д.) относятся к совокупности атомов или молекул.
По химическому составу неорганические вещества делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента (например, H2, O2).
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В периодической таблице Д.И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведённой через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Сложными называют вещества, которые состоят из атомов двух и более элементов (например, H2S, NO2).
Для выражения состава вещества используют различные химические формулы. При их написании используют общепринятые символы химических элементов. Символ элемента состоит из первой буквы или первой и одной из последующих букв латинского названия элемента, при этом первая буква всегда прописная, а вторая — строчная.
Названия и обозначения атомов совпадают с символами химических элементов. Например, О — атом кислорода, 2О — два атома кислорода, О2 — молекула кислорода, О3 — молекула озона.
Сложные вещества разделяют на условно электроположительную (катион) и условно электроотрицательную (анион) составляющие. В формуле сложного вещества вначале ставят катион, а затем — анион, например KBr, CuSO4. Названия сложного вещества читают справа налево, т. е. вначале называют его электроотрицательную составляющую в именительном падеже, а затем электроположительную в родительном падеже.
Для бинарных, т. е. состоящих из двух элементов соединений, действуют следующие правила. Если соединение состоит из металла и неметалла, то на первом месте всегда ставят металл (как более электроположительный элемент): K2S, BaCl2.
В формулах соединений, состоящих только из неметаллов, на первом месте всегда ставят элемент, находящийся левее в условном ряду неметаллов, построенном по их возрастающей электроотрицательности:
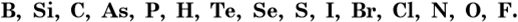
Например, IBr — бромид йода, CS2 — дисульфид углерода.
Формула молекулярная (брутто-формула) включает символы всех химических элементов, входящих в состав соединений. Около каждого символа ставят числовой индекс, показывающий, сколько атомов данного вида входит в состав соединения. Таким образом, молекулярная формула показывает качественный и количественный состав молекулы. Например, формула KNO3 показывает, что вещество состоит из 1 атома калия (индекс, равный 1, не ставится), 1 атома азота и 3 атомов кислорода.
Чтобы правильно прочитать формулу, надо знать как русские, так и латинские обозначения элементов. Называя вещество «вода», мы говорим, что его формула H2O (читается «аш два о»). Данное вещество состоит из двух атомов водорода и одного атома кислорода.
Называя вещество сульфат калия, K2SO4, мы читаем его формулу «калий два эс о четыре». Данное вещество состоит из двух атомов калия, одного атома серы и четырех атомов кислорода.
Если в формуле структурный фрагмент повторяется несколько раз, его заключают в круглые скобки и за скобками ставят числовой индекс, который произносят «дважды», «трижды», например, Ca(NO3)2 читается «кальций эн о три дважды», Mg3(PO4)2 читается «магний три пэ о четыре дважды».
Коэффициент, стоящий перед формулой вещества в уравнении реакции, читают как число, например: 3HNO2 — «три аш эн о два».
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и атома кислорода со степенью окисления –2.
Называют оксиды, руководствуясь следующими правилами:
1. Вначале указывают слово оксид, а затем в родительном падеже название второго элемента;
2. Если элемент может образовать несколько оксидов, то после названия элемента в скобках указывают его валентность;
3. При написании формул оксидов кислород всегда ставят на втором месте.
Примеры: K2O — оксид калия, N2O5 — оксид азота (V), CrO3 — оксид хрома (IV).
Для некоторых распространённых оксидов используют тривиальные названия, например CaO — негашеная известь, N2O — веселящий газ, CO — угарный газ, CO2 — углекислый газ.
Оксиды классифицируют так.
Низшими называют оксиды, в которых элемент проявляет низшую степень окисления, например MnO — оксид марганца (II).
Высшими называют оксиды, в которых элемент проявляет высшую степень окисления, например Mn2O7 — оксид марганца (VII).
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни основные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Кислотные оксиды образуют неметаллы и некоторые металлы в высших степенях окисления. Примеры кислотных оксидов: CO2, SiO2, N2O3, NO2, N2O5, P2O3, P2O5, SO2, SO3, Cl2O5, Cl2O7, CrO3, Mn2O7.
Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, Rb2O, Cs2O, MgO, CaO, SrO, BaO, Cu2O, Ag2O, HgO, CrO, FeO.
Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства, в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания, например: NaOH — однокислотное, Mg(OH)2 — двухкислотное и т. д.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щёлочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Называют основания следующим образом:
1. Вначале указывают слово гидроксид, а затем добавляют название металла в родительном падеже;
2. Если элемент может образовывать несколько оснований, то после его названия в круглых скобках римской цифрой указывают валентность: KOH — гидроксид калия, Fe(OH)2 — гидроксид железа (II), Fe(OH)3 — гидроксид железа (III);
3. При написании формул гидроксидов гидроксильную группу всегда ставят на втором месте.
4. Кислотами называют класс химических соединений, которые содержат в своём составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
5. Основностью кислоты называют число способных замещаться на металл атомов водорода в её молекуле. По основности кислоты делят на одно-, двух- и трёхосновные, например HBr, H2S и H3PO4 соответственно.
6. В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3. Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
7. В таблице 4 приведены формулы и названия наиболее распространенных кислот и их солей.
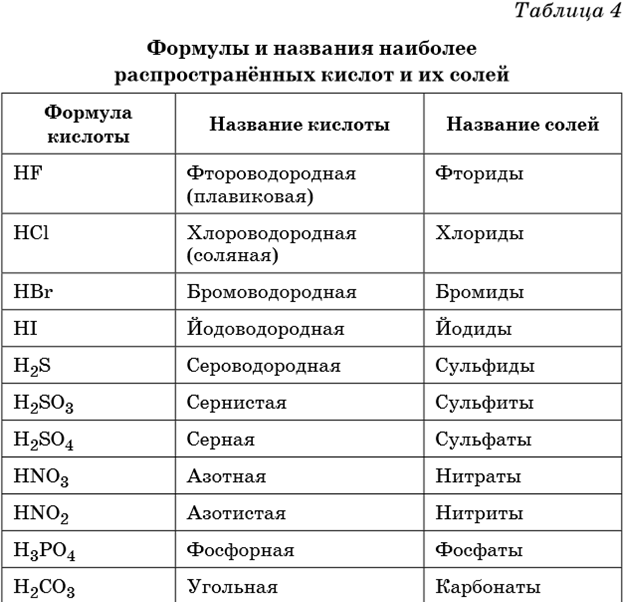
8.
9. Сильные кислоты: HI, HBr, HCl, HClO3, HClO4, H2SO4, HNO3.
10. Кислоты средней силы: H2SO3, H3PO4, HF, HNO2.
11. Слабые кислоты: CH3COOH, H2CO3, H2S, H2SiO3.
12. Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
13. Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2. Некоторые гидроксиды, например Cu(OH)2, Fe(OH)3, проявляют амфотерные свойства с преобладанием основных.
3 вопрос Вещества постоянного и переменного состава. Смеси веществ. Различия между смесями и химическими соединениями.

Понятие о смеси веществ.
Чистое вещество имеет определенный постоянный состав или структуру (соль, сахар).
 В жизни редко встречаются чистые вещества, чаще - смеси веществ. Воздух – это смесь азота, кислорода и других газов, морская вода – смесь воды и растворенных солей.
Смеси - это физические сочетания чистых веществ, не имеющие определенного или чистого состава.
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием "чай" всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
Гомогенные и гетерогенные смеси.
Гетерогенные смеси полностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы.
Гомогенные смеси — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
- газовые смеси;
- растворы;
- твёрдые растворы.
Гетерогенные смеси двух веществ можно разделить по агрегатным состояниям на следующие группы: В жизни редко встречаются чистые вещества, чаще - смеси веществ. Воздух – это смесь азота, кислорода и других газов, морская вода – смесь воды и растворенных солей.
Смеси - это физические сочетания чистых веществ, не имеющие определенного или чистого состава.
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием "чай" всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
Гомогенные и гетерогенные смеси.
Гетерогенные смеси полностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы.
Гомогенные смеси — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
- газовые смеси;
- растворы;
- твёрдые растворы.
Гетерогенные смеси двух веществ можно разделить по агрегатным состояниям на следующие группы:
|
 2020-09-24
2020-09-24 453
453







