| Рисунок 1.1 – Условное изображение оболочки атома: планетарная (а) и вероятност- ная (б) модели |
| б) |
| а) |
Наглядным представлением планетарной модели является система круговых и эллиптических орбит, окружающих атомное ядро, и этот красивый рисунок 1.1, а стал эмблемой атомного века, однако сейчас такие картинки не рисуют. В процессе осознания природы электрона обнаружено, что он имеет двойственный корпускулярно-волновой характер, и в некоторых случаях проявляет себя как частица, а в некоторых – как электромагнитная волна. Движущийся электрон не имеет чётких границ и распределён в пространстве, ему соответствует так называемая волна вероятности, для которой квадрат модуля смещения пропорционален плотности вероятности обнаружить электрон в данной точке пространства. В настоящее время атом условно рисуют в виде ядра, окружённого облаком вероятности присутствия электронов (рисунок 1.1, б). Однако такая «туманная» модель не подчёркивает ни квантового характера изменения энергетического состояния атома, ни различия в свойствах химических элементов, поэтому мы будем продолжать пользоваться понятием электронных оболочек, представляя их как условные поверхности максимальной вероятности присутствия электронов, имеющих одинаковый уровень энергии.
Периодическая система химических элементов Дмитрия Ивановича Менделеева является иллюстрацией процесса заселения электронных оболочек по мере увеличения заряда ядра и количества электронов. Современный вариант таблицы можно найти здесь. Она соответствуют длинному варианту (длиннопериодной форме), утверждённому Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного
Раскраска групп и семейств в таблице также соответствует рекомендациям ИЮПАК, однако она несколько усовершенствована. Способом заливки фона различными цветами обозначены слева направо: щелочные металлы (фиолетовый); щелочноземельные металлы (синий); переходные металлы (голубой); постпереходные металлы (зелёный); полуметаллы – металлоиды (жёлто-зелёный); другие неметаллы (жёлтый); галогены (оранжевый); благородные газы (красный). Внизу показаны лантаниды (светло-бирюзовый) и актиниды (бирюзовый). Такая раскраска позволяет глубже понять связь химических свойств элементов с их положением в Периодической системе и строением электронных оболочек. Изменение раскраски слева-направо соответствует цветам спектра от фиолетового до красного, что позволило сделать её доступной для восприятия даже людям с нарушениями цветового зрения (дальтоникам), количество которых составляет 8-9 % населения. Для обозначения радиоактивности использован серый цвет букв и символов.
Информация по каждому элементу: – атомная масса; электроотрицательность по Полингу; номер, символ, характерные и возможные степени окисления, русское название. Для электроотрицательности использована таблица из англоязычной Википедии. Это самая свежая информация, которая регулярно проверяется и подновляется ведущими мировыми специалистами. Однако эта таблица не содержит информации по гелию, неону, аргону. Эта информация восполнена из таблицы русскоязычной Википедии. Степени окисления приведены в соответствии с англоязычной Википедией в порядке убывания, за исключением некоторых случаев, когда требовалось подчеркнуть характерные отрицательные; например хлор: -1753 6…0. Здесь большие жирные цифры показывают характерные, а остальные – возможные степени окисления.
Атом водорода 1H имеет один электрон, который не в состоянии окружить протон одновременно со всех сторон, поэтому атом водорода активно стремится объединиться с другим атомом (водорода или иного элемента), также имеющим неполную оболочку. При объединении получается общая оболочка, так образуются молекулы. У гелия 2He два электрона, его оболочка полностью завершена и он не проявляет никакой активности. Гелий существует только в атомарном виде и возглавляет группу благородных газов. Он конденсируется только при 4,2 К, а затвердевает при 0,5 К; в жидком гелии атомы так слабо связаны между собой, что он обладает сверхтекучестью. Незаполненная оболочка атома 1H побуждает водород к химическим связям, а заполненная оболочка атома гелия 2He обеспечивает ему инертность.
Атом лития 3Li имеет три электрона, два из которых образуют первую оболочку, а третий находится на втором, более высоком разрешённом энергетическом уровне. Литий стремится избавиться от внешнего электрона и превратиться в шарик-ион, это проявление металлических свойств, а литий – очень активный (щелочной) металл. У бериллия 4Be два электрона находятся на верхнем уровне, однако чтобы заселить вторую оболочку этого недостаточно; бериллию легче отдать электроны, чем принять. По мере увеличения количества электронов на втором энергетическом уровне металлические свойства элементов ослабевают, и начинается заселение второй оболочки. У атомов бора 5B стремления отдать свои электроны, и заполучить чужие, выражены в равной мере. У углерода 6C вторая оболочка заселена наполовину, в ней не хватает 4 электронов, поэтому атом углерода стремится объединить свои электроны с электронами других атомов. Атом углерода может образовать 4 связи с другими атомами; благодаря способности углерода к образованию сложных молекул он является основой жизни. Азот 7N способен образовать 3 связи, что обеспечивает особую прочность и слабую химическую активность молекул N2. По мере заселения второй оболочки возрастают неметаллические свойства элементов, т. е. стремление достроить оболочку за счёт чужих электронов. Кислород 8O активно образует связи почти со всеми элементами. У фтора 9F во второй оболочке не хватает всего одного электрона, он является самым активным из неметаллов.
У неона 2 + 8 = 10Ne на втором уровне 8 электронов, его вторая оболочка заполнена. Октет электронов делает неон благородным газом c температурой кипения 27,2 К, плавления 24,5 К.
Третья оболочка от натрия 2 + 8 + 1 = 11Na до аргона 2 + 8 + 8 = 18Ar формируется аналогичным образом; металлические свойства элементов постепенно уменьшаются, а неметаллические – возрастают. У аргона внешняя оболочка представляет собой октет электронов, что делает его благородным газом с температурой кипения 87,5 К, плавления 84 К.
Возрастание заряда ядра и появление последующих электронов делают калий 19K щелочным, а кальций 20Ca– щелочноземельным металлами. Начиная со скандия 21Sc, увеличение числа электронов приводит к возможности уплотнения третьей оболочки и проявлению переменной валентности, что является общим свойством переходных элементов. Всего переходных элементов 68, часть их получены искусственно, все они металлы, т. о. большинство химических элементов – переходные металлы. Скандий возглавляет семейство из 32 редкоземельных металлов, самое многочисленное, включающее в себя подгруппы из 14 лантанидов и 14 актинидов. Окисление скандия, титана, ванадия, хрома и марганца возможно до тех пор, пока в третьей оболочке не останется октет из 8 электронов, у марганца 25Mn возможная степень окисления доходит до +7. Если внешние электроны этих металлов не участвуют в химических связях, они уплотняют третью оболочку. У железа 26Fe и остальных элементов группы железа (кобальта 27Co и никеля 28Ni) способность к окислению меньше, зато эти металлы способны сильно намагничиваться. У меди 2 + 8 + 18 +1 = 29Cu три оболочки заполнены, а внешний электрон обеспечивает высокую электропроводность. На цинке 30Zn переход заканчивается и с галлия 31Ga происходит последовательное заселение четвёртой оболочки с уменьшением металлических и увеличением неметаллических свойств. У криптона 2 + 8 + 18 + 8 = 36Kr внешняя оболочка – октет электронов. Он является благородным газом, однако при низких температурах способен соединяться с фтором.
Пятый период аналогичен четвёртому, начиная с циркония 40Zr, проявляется переменная валентность за счёт уплотнения четвёртой оболочки. У рутения 44Ru степень окисления может доходить до +8, вместе с тем, благодаря своей инертности он является первым из драгоценных металлов платиновой группы; в пятом периоде за ним следуют родий и палладий. У серебра 2 + 8 + 18 + 18 + 1 = 47Ag три оболочки заполнены, в четвёртой – 18 электронов и один внешний. Такая конфигурация делает серебро чемпионом по электропроводности. На кадмии 48Cd переход заканчивается и с индия 49In происходит последовательное заселение пятой оболочки. У ксенона 2 + 8 + 18 + 18 + 8 = 54Хе три оболочки заполнены, четвёртая состоит из 18 электронов, внешняя пятая – октет. Ксенон считается благородным газом, хотя некоторые его соединения с фтором устойчивы до температуры 180 °С.
Шестой период начинается с цезия и бария, переходит к лантану, а затем, начиная с церия 58Се, уплотняется 4-я оболочка, на которой может поместиться 32 электрона. В процессе уплотнения четвёртой оболочки образуется группа из 14 редкоземельных металлов, близких по свойствам и имеющих общее название «лантаниды». Здесь возможна конкуренция между 4 и 5 оболочками, благодаря чему редкоземельные металлы обладают особыми свойствами в отношении магнетизма, люминесценции и сверхпроводимости. После заполнения 4-й оболочки, начиная с гафния 72Hf, происходит заселение пятой до тех пор, пока у золота 79Au на ней не окажется 18 электронов. На ртути 80Hg переход заканчивается и происходит заселение шестой оболочки, сопровождаемое соответствующим изменением химических свойств, однако после висмута 83Bi все элементы радиоактивны и распадаются из-за нестабильности ядра. У радона четыре оболочки заполнены 2 + 8 + 18 + 32 + 18 + 8 = 86Rn, пятая состоит из 18 электронов, а внешняя шестая – октет. Этот газ тоже считается благородным, хотя образует соединения с фтором состава RnF n, где n = 4, 6, 2.
Анализируя заполнение оболочек неона, аргона, криптона, ксенона и радона, можно заметить, что инертность этих газов обеспечена 8-электронной внешней оболочкой, причём внутренние оболочки, могут быть незаполненными, но содержать 18 электронов. Если в атомах благородных газов есть 18-электронные оболочки, то сверхактивный фтор способен «поживиться» их электронами, достраивая свой октет. Очевидно, что причина устойчивости электронной оболочки заключается в её объёмной симметрии. Наибольшей симметрией обладает сфера, однако следует учесть, что оболочка образуется отдельными электронами, т. е. за её модель можно принять многогранник, в котором каждый электрон обеспечивает своим присутствием одну грань. Особая устойчивость оболочки проявляется в том случае, если её поверхность распределена между электронами поровну, т. е. многогранник должен быть правильным. Правильный восьмигранник называется октаэдром, он изображен на рисунке 1.2, а.
а) б)
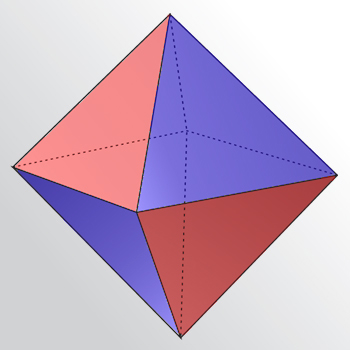
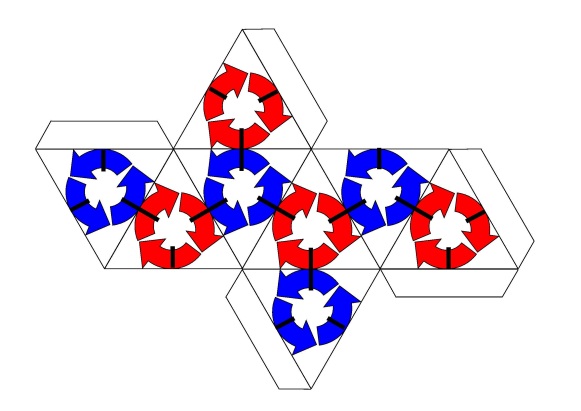
Рисунок 1.2 – Октаэдр (а) и модель октета электронов на его гранях (б)
Октаэдр, моделирующий октет, является уникальной фигурой. Он единственный из правильных многогранников обеспечивает чередование цветов на его гранях, моделирующее магнитное притяжение (синий цвет – северный магнитный полюс, красный – южный. Мы считаем, что именно симметрия октета, отнюдь не кубическая, а октаэдрическая, делает его особо устойчивым к химическим воздействиям и обеспечивает инертность благородных газов. Причиной является магнитное притяжение между соседними электронами, имеющими разные направления вращения (спины); оно обеспечивает инертность октета. Это притяжение показано на рисунке 1.2, б чёрными полосками.
Физические свойства химических элементов можно посмотреть тут. Здесь применены различные цвета и различные способы раскраски.
Цвета заливки фона:
– Светло-коричневый – ферромагнетики (по цвету ржавчины на железе). Это железо, никель, кобальт, а также 5 редкоземельных металлов, проявляющих магнитные свойства при пониженной температуре: гадолиний, тербий, диспрозий, гольмий, эрбий.
Бледно-зелёный – полупроводники, их 12. В порядке возрастания ширины запретной зоны: альфа-олово, сурьма, теллур, германий, бор, кремний, мышьяк, йод, чёрный фосфор, селен, сера, углерод.
Светло-жёлтый – благородные (драгоценные) металлы (по цвету золота). Это золото, серебро, платина, а также металлы платиновой группы – палладий, иридий, родий, рутений и осмий.
Сиреневый – сверхпроводники. Здесь приведены только элементы с температурой перехода в сверхпроводящее состояние выше 4,2 К (температура кипения гелия). При меньших температурах, особенно вблизи 0 К, в сверхпроводящее состояние может быть переведено большинство металлов. Сиреневым раскрашены: ниобий, свинец, ванадий, технеций, лантан, тантал, кремний (в тонких плёнках), ртуть.
Бледно-голубой – жидкости и элементы с температурой плавления ниже 100 ºС. Это щелочные металлы: натрий, калий, рубидий, цезий, франций, а также галлий, бром и ртуть.
Светло-бирюзовый – газы (газы бледнее, чем жидкости). Это водород, гелий, азот, кислород, фтор, неон, хлор, аргон, криптон, ксенон и радон.
Цветные буквы и рамки:
Синие буквы – температура плавления ниже 1000 ºС; синие буквы совместно с синей рамкой – легкоплавкие элементы (температура плавления ниже 300 ºС); чем больше синего, тем ниже температура плавления.
Красные буквы – тугоплавкие (температура плавления выше 1524 ºС – плавление железа); красные буквы совместно с красной рамкой – температура плавления выше 3000 ºС; чем больше красного тем выше температура плавления.
Элементы с температурой плавления от 1000 ºС до 1524 ºС оставлены чёрными.
Серые буквы (на тёмном фоне белые) – радиоактивность (для элементов с периодом полураспада более суток – в названии элемента, менее суток – в обозначении латинского символа, чем больше серого, тем выше радиоактивность).
Цветная раскраска применена своя для каждого химического элемента периодической системы в зависимости от его физических свойств. При сочетании свойств цвета также сочетаются (например, ртуть и жидкость и сверхпроводник; фон залит сверху бледно-голубым, снизу сиреневым).
Условная граница между металлами и неметаллами проведена чёрной штриховой линией.
Несимметрия незаполненных внутренних оболочек переходных металлов является причиной магнетизма. Первой теорией магнетизма была гипотеза Ампера, который считал его проявлением внутримолекулярных токов. Изучение молекул и кристаллов показало, что они состоят из атомов. Таким образом, речь должна идти о внутриатомных движениях электронов, которые можно рассматривать как замкнутые электрические токи, при этом каждый электрон создаёт собственное магнитное поле. В заполненной электронной оболочке магнитные поля отдельных электронов компенсируют друг друга. Электроны внешней оболочки (валентные) компенсируют свои магнитные поля за счёт электронов других атомов, в результате большинство веществ практически немагнитны. Магнетизм является отклонением от этого принципа компенсации. Магнитные атомы представляют собой очень маленькие, но сильные магниты, в которых магнитные поля отдельных электроновне компенсируются, а наоборот, складываются. Это возможно, когда электронные оболочки не заполнены, что характерно для переходных элементов. Сильные магнитные свойства проявляют железо, кобальт и никель, а также (при пониженных температурах) пять редкоземельных металлов – гадолиний, диспрозий, гольмий, эрбий и тербий. Перечисленные элементы способны проявлять магнитные свойства не только сами по себе, но и в соединениях, в том числе с немагнитными элементами. Однако присутствие атомов перечисленных металлов не является обязательным условием магнетизма. Известны сплавы Гейслера, элементы которых по отдельности не проявляют магнитных свойств, однако, в процессе соединения в виде сплава, у некоторых из них происходит перестройка оболочек, в результате которой весь сплав становится магнитным.
 2020-09-24
2020-09-24 282
282








