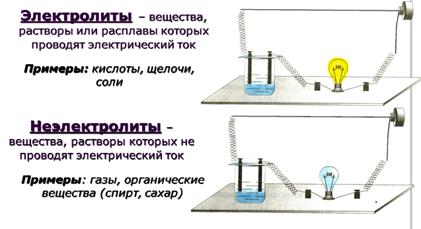
Вещества, водные растворы или расплавы которых проводят электрический ток, называют электролитами. Неэлектролиты – это вещества, растворы и расплавы которых электрический ток не проводят.
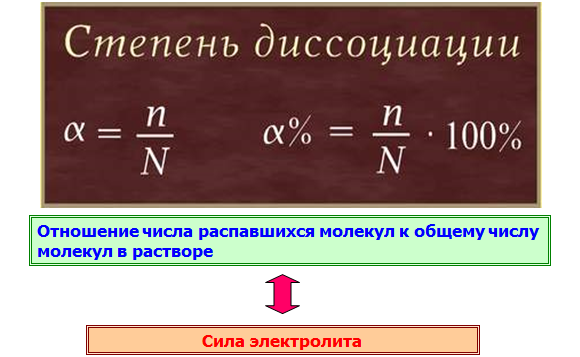
Количественной характеристикой процесса диссоциации служит степень диссоциации, от которой зависит сила электролита. Степень диссоциации – это отношении числа распавшийся молекул к общему числу молекул в растворе.
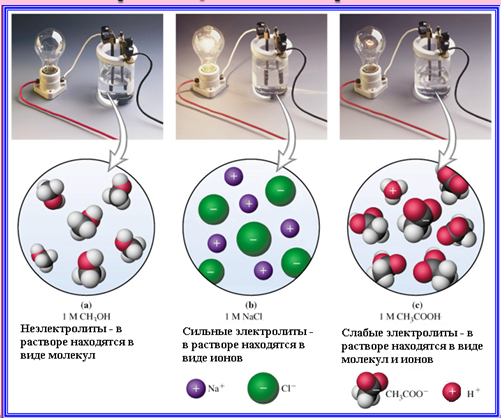
Электролиты различают сильные и слабые.
В водных растворах сильные электролиты распадаются на ионы полностью, а слабые – не полностью. Поэтому в растворах сильных электролитов находятся только ионы, а в растворах слабых электролитов и ионы, и недиссоциированные молекулы.
| Сильные электролиты | Слабые электролиты |
| Средние водорастворимые соли Кд=1 | Практически нерастворимые соли и основания (ПР-справочная величина) |
| Сильные (минеральные) кислоты Ка=1 | Слабые кислоты и органические кислоты Ка – справочная величина |
| Щелочи Кв=1 | Аммония гидроксид (ПР- справочная величина) |
| Комплексные соединения Кнест – справочная величина | Вода Кw= 10-14 |
Вода как слабый электролит в незначительной степени диссоциирует на ионы
Н2О = Н+ + ОН-
1 моль 1 моль 1 моль
То есть при диссоциации одной молекулы воды образуется один ион водорода и один ион гидроксида. При комнатной температуре в одном литре воды диссоциирует только 10-7 моль воды. Т.е. при диссоциации образуется 10-7 моль ионов водорода и 10-7 моль гидроксид-ионов.
Ионное произведение воды (Кw) – это произведение концентраций ионов Н+ и ОН- (обозначается Кw). Эта величина постоянная.
Kw = [H+] [OH-] = 10-14
 2020-09-24
2020-09-24 399
399








