Пользоваться истинными концентрациями неудобно, поэтому применяют их логарифмы взятые с обратным знаком. Выделяют водородный показатель рН и гидроксильный показатель рОН
Эти показатели взаимосвязаны через ионное произведение воды
рН + рОН = 14
pH = -lg [H+] для расчета рН сильных кислот
pОH = -lg [ОH-] для расчета рН сильных оснований или pH =14 + lg [ОH-]
По реакции среды растворы делят на:
Нейтральные рН=7
Кислые рН<7
Щелочные pH>7

Существуют различные методы измерения рН. С помощью рН-метров и индикаторов.
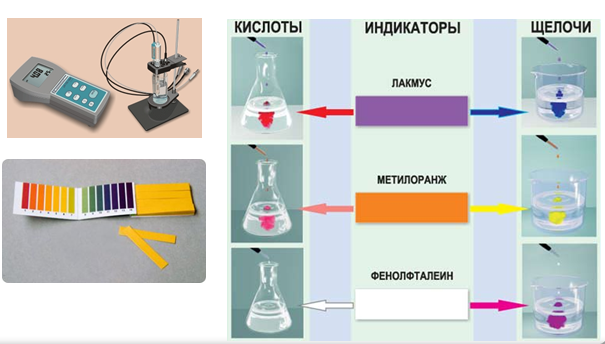
Индикаторы – это вещества, которые обратимо изменяют свой цвет в зависимости от рН раствора.
| Индикатор | В щелочных растворах | В кислых растворах | В нейтральных растворах |
| лакмус | синий | красный | фиолетовый |
| фенолфталеин | малиновый | бесцветный | бесцветный |
| метилоранж | желтый | розовый | оранжевый |
Расчет рН раствора сильной кислоты и сильного основания
Задача 1.
Вычислить рН в 0,01М HCl и NaOH
Решение.
Соляная кислота относится к сильным кислотам, поэтому можно принять концентрацию ионов водорода равной концентрации кислоты [H+] = 0,01 моль/л.
Значение рН=–lg 0,01 =2.
Гидроксид натрия относится к сильным основаниям, поэтому можно принять концентрацию гидроксил-ионов равной концентрации основания[ОH-] = 0,01 моль/л
Значение рН= 14–lg [ОH-] =12.
Растворимость. Равновесие в гетерогенной системе раствор-осадок. Произведение растворимости (ПР). Условия образования и растворения осадков. Дробное осаждение и разделение.
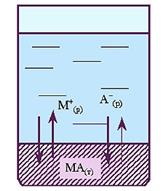
В растворе с осадком происходят постоянные процессы растворения осадка и осаждения. Концентрация ионов в растворе над осадком величина постоянная
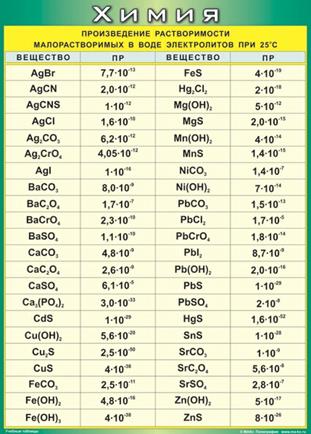
Произведение концентраций ионов в насыщенном растворе труднорастворимого электролита постоянная величина называется произведением растворимости ПР
Например для CaCO3
ПР = [Са2+][СО32-]= 4,76 ∙ 10-9 (справочная величина).
Гидролиз солей
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды.

рН воды=7, но при растворении хлорида железа (III) рН-метр выдает значение 2,34. Откуда в растворе соли появляются ионы водорода? И учеными было выяснено, что некоторые соли реагируют с водой.
1. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу: NaCl, K2SO4, NaNO3.
Имеют нейтральную реакцию среды, рН = 7.
2. Соли образованные катионом сильного основания и слабой кислоты подвергаются гидролизу по аниону: Na2CO3, Na2S, K2SO3, CH3COOK, NaCN, Ba(NO2)2.
Na2S + H2O ↔ NaHS + NaOH
2Na+ + S2- + H2O ↔ Na+ + HS- + Na+ + OH-
S2- + H2O ↔ HS- + OH-
Растворы имеют щелочную реакцию среды, рН>7.
3. Соли образованные катионом слабого основания и сильной кислоты подвергаются гидролизу по катиону: ZnCl2, FeCl3, CuCl2, NH4I, Al2(SO4)3.
FeCl2 + H2O ↔ FeOHCl + HCl
Fe2+ 2Cl- + H2O ↔ FeOH- +Cl- + H+ + Cl-
Fe2+ + H2O ↔ FeOH+ + H+
Растворы имеют кислотную реакцию среды, рН<7.
4. Соли образованные катионом слабого основания и слабой кислоты подвергаются гидролизу по катиону и аниону: CH3COONH4, (NH4)2S, NH4CN
CH3COONH4 +HOH↔CH3COOH+NH4OH
CH3COO- + NH4+ +HOH↔CH3COOH+NH4OH
В результате гидролиза ацетата аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН~7.
 2020-09-24
2020-09-24 128
128







