Лекция № 2 РАСТВОРЫ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. РАВНОВЕСИЕ В ГЕТЕРОГЕННОЙ СИСТЕМЕ РАСТВОР – ОСАДОК.
Содержание лекции
Общие понятия о растворах. Способы выражения состава раствора. Химическое равновесие. Константа химического равновесия, способы ее выражения. Смещение химического равновесия. Слабые, сильные электролиты. Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. Растворимость. Равновесие в гетерогенной системе раствор-осадок. Произведение растворимости (ПР). Условия образования и растворения осадков. Дробное осаждение и разделение. Гидролиз солей.
- Общие понятия о растворах. Способы выражения состава раствора.
Растворами называют гомогенные системы, состоящие из двух и более компонентов. Компонентами раствора являются растворитель и растворенные вещества.
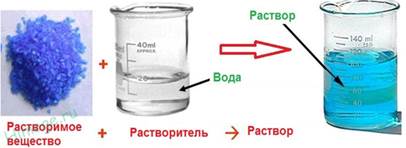
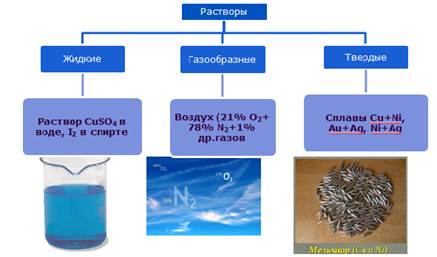
Растворы бывают жидкие (растворы солей, сахара, спирта, кровь, моча), твердые (сплавы металлов) и газообразные (воздух).
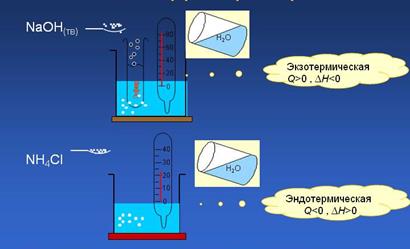
Растворение – это физико-химический процесс. При физическом процессе происходит разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя.
Химический процесс – это взаимодействие молекул растворителя с частицами растворенного вещества с образованием сольватов (в случае воды гидратов). Процесс образования сольватов называется – сольватация (гидратация).
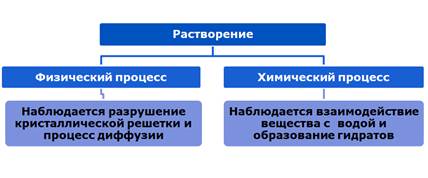
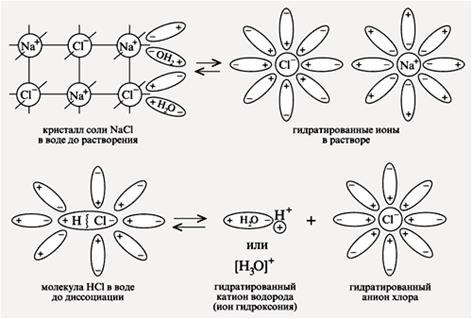
Физический процесс идет с поглощением энергии, химический – с выделением.
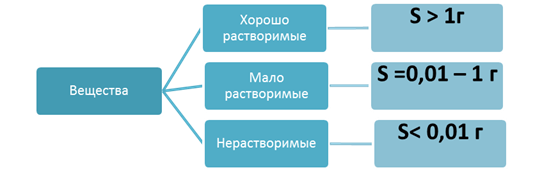
Растворимость – свойство вещества растворяться в воде или другом растворе.
Коэффициент растворимости (S) – максимальное число г вещества, которое может раствориться в 100г растворителя при данной температуре.
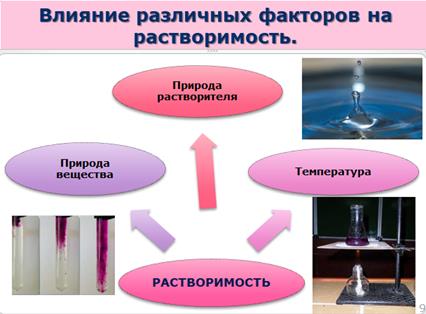
На растворимость веществ влияют следующие факторы: природа вещества и растворителя, температура.
При растворении веществ могут образовываться насыщенные, насыщенные и перенасыщенные растворы.
Насыщенный раствор – это раствор, который содержит максимальное количество растворяемого вещества при данных условиях. При добавлении вещества в такой раствор вещество больше не растворяется. Насыщенный раствор можно получить, если осторожно слить раствор над осадком в другую пробирку.
Ненасыщенный раствор – это раствор, который содержит меньше растворяемого вещества. При добавлении вещества в такой раствор вещество еще растворяется.
Иногда удается получить раствор, в котором растворенного вещества содержится больше, чем в насыщенном растворе при данной температуре. Такой раствор называется перенасыщенным.
| Не переписывать | Получают следующим образом, в кипящую воды помещают вещество и полученный раствор в горячем виде фильтруют. Далее ставят охлаждаться при комнатной температуре. При этом растворимость вещества падает и согласно закону лишнее вещество (превышающее предел растворимости) должно выпасть в осадок. Но раствор остается прозрачным. Но данные растворы крайне неустойчивы. Достаточно перемешать раствор стеклянной палочкой и тут же начинается выпадение вещества в осадок. Это способ применяется при выполнении некоторых качественных реакций, а также при выращивании кристаллов. |

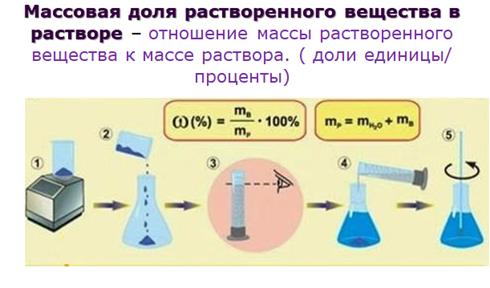
Концентрация вещества в растворе может быть выражена несколькими способами:
Например, растворили 5 г натрия хлорида в 0,2 л воды
Рассчитаем молярную концентрацию вещества:
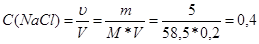 моль/л.
моль/л.
Рассчитаем процентное содержание натрия хлорида в растворе
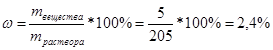
Химическое равновесие. Константа химического равновесия, способы ее выражения. Смещение химического равновесия. Закон действующих масс. Расчет равновесных концентраций.
Все реакции можно разделить на обратимые и необратимые.
К необратимым реакциям относятся: реакции с образованием газа, осадка, малодиссоциирующего вещества, с образованием комплексов и окислительно-восстановительные реакции.
В необратимым реакциях одно вещество расходуется полностью.
Обратимые реакции как правило не протекают до конца и реагирующие вещества не расходуются полностью. В обратимых реакциях одновременно реакция идет в двух противоположных направлениях. Состояние когда скорости прямой и обратной реакции равны называется химическим равновесием.
Химическое равновесие характеризуется константой равновесия.
| Перечертить | 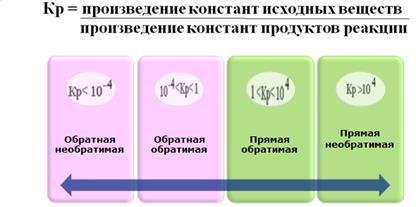
|
Если Кр=1 реакция не протекает,
Все константы возводятся в степень соответствующую стехиометрическому коэффициенту в реакции.
Если исходное вещество без изменения входит в продукт, то слева в реакции для этого вещества проставляется 1.
Задача №1
Рассчитайте значения константы равновесия:
AgCl(т) + 2NH3 = [Ag(NH3)2]Cl
Ход решения
1. Определим агрегатное состояние исходных веществ и продуктов и запишем в скобках
AgCl(т) + 2NH3(г) = [Ag(NH3)2]Cl (ж)
2. AgCl – нерастворим в воде характеризуется как все осадки ПР
NH3 – входит без изменения в продукт поэтому К=1
[Ag(NH3)2] — комплексная частица, слабый электролит характеризуется Кнест.
3. Запишем формулу расчета Кр
Кр = произведение констант исходных веществ / произведение констант продуктов реакции
Подставим значения
Кр= 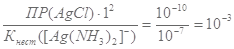
Кр<1, поэтому преобладает обратная реакция, для сдвига равновесия в сторону образования продуктов необходимо добавить избыток аммиака.
Умение рассчитать константу химического равновесия необходимо для предсказания будет протекать данная химическая реакция или нет, какие условия необходимо создать для протекания химической реакции.
 2020-09-24
2020-09-24 394
394







