Одноатомные спирты – наркотики. Их токсичность возрастает с увеличением числа атомов углерода.
Метиловый спирт – сильный нервный и сосудистый яд, снижает насыщаемость крови кислородом. Метанол принятый внутрь взывает опьянение и тяжелое отравление сопровождаемое потерей зрения.
Метанол в пищеварительном тракте окисляется в токсичнее продукт – формальдегид и муравьиную кислоту, которые в небольших количествах взывают тяжелые отравления организма и смерть:
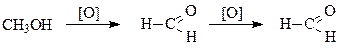
Этиловый спирт – наркотик, взывает паралич нервной системы.
Попадая в организм человека, спирт действует сначала возбуждающе, а затем угнетающе на ЦНС, притупляет чувствительность, ослабляет функцию головного мозга, значительно ухудшает реакцию.
Главной причиной поражения организма этанолом является образование ацетальдегида, который оказывает токсическое воздействие и взаимодействует со многими метаболитами. Ацетальдегид образуется в результате действия фермента алкогольдегидрогеназы (содержится в печени).
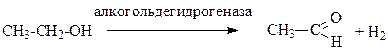
Пропиловый спирт действует на организм аналогично этиловому, но сильнее последнего.
Жиры – вещества главным образом животного и растительного происхождения, состоящие в основном из сложных эфиров глицерина и одноосновных высших карбоновых кислот (триглицеридов):
СН2 – ООС – R
 |
CH – OOC – R
 |
CH2 – OOC – R
Чаще всего в состав жиров входят насыщенные кислоты - пальмитиновая С15Н31СООН, стеариновая С17Н35СООН и ненасыщенная кислота – олеиновая С17Н33СООН. В небольших количествах в природных жирах находятся также и другие предельные одноосновные кислоты от С4 до С24 и непредельные кислоты с несколькими двойными связями. При этом в составе природных жиров встречаются исключительно кислоты с четным числом углеродных атомов. Это связано с характером обмена веществ в животных и растительных организмах.
Исследуя жиры, французский химик М.Э. Шеврель установил, что жиры состоят из глицерина и кислот, получивших название жирных. В дальнейшем это название было распространено вообще на соединения, содержащие нециклический углеводородный радикал. И сегодня еще употребительно для этих соединений название соединения жирного ряда. Синтез жиров из глицерина и жирных кислот был впервые осуществлен в 1854г. М. Бертло.
Вместе с белками и углеводами жиры входят в число важнейших с биохимической точки зрения веществ. Поступающие с пищей жиры в процессе пищеварения расщепляются на глицерин и жирные кислоты; эти вещества всасываются в кишечнике, затем из них вновь синтезируются жиры. Жиры источник энергии в организме; калорийность чистого жира 3770 кДж (900 ккал)/100 г.
Жиры разного происхождения внешне различаются прежде всего по своему физическому состоянию: они бывают твердыми (животные жиры) и жидкими (растительные масла: жирные, растительные жиры, получаемые из семян и плодов растений отжимом или экстрагированием. Различают р.м. твердые и (чаще) жидкие; высыхающие (льняное, конопляное), полувысыхающие (подсолнечное, хлопковое), невысыхающие (касторовое, кокосовое). Многие р.м. – важные пищевые продукты; их используют также для производства маргарина, мыла, олифы, лаков и др.). При химическом исследовании жиров было выяснено, что в твердых жирах преобладают триглицериды предельных кислот (пальмитиновой, стеариновой), в жидких – содержится значительный процент триглицерида непредельной (олеиновой) кислоты. В индивидуальном виде эти триглицериды имеют следующие точки плавления: трипальмитин +65оС, тристеарин +72оС, триолеин – 4оС.
В коровьем масле в отличие от других жиров содержится в некотором количестве также эфир глицерина с низкомолекулярной масляной кислотой – трибутирин. Отсюда масляная кислота и получила свое название. Осуществляя гидрогенизацию жиров (присоединение к ним водорода в присутствии никелевого катализатора), в промышленном масштабе превращают жидкие жиры в твердые, идущие на производство маргарина, а также для других целей.
Старейшее техническое использование жиров – получение мыла. Если жир нагреть со щелочью, то происходит (как у всякого сложного эфира) его гидролиз с образованием глицерина и солей жирных кислот, которые и составляют мыло:
 СН2 – ООС – С17Н35 СН2 – ОН
СН2 – ООС – С17Н35 СН2 – ОН
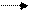
 СН – ООС – С17Н35 + 3NаОН СН – ОН + 3С17Н35СООNа
СН – ООС – С17Н35 + 3NаОН СН – ОН + 3С17Н35СООNа
СН2 – ООС – С17Н35 СН2 – ОН
Часто употребляемое для процессов гидролиза второе название – омыление обязано своим происхождением этому старинному процессу.
Технически более удобный способ расщепления жиров основан на использовании кислых катализаторов: серной кислоты, сульфокислот нафтеновых углеводородов (так называемый контакт Петрова), продуктов сульфирования касторового масла (реактив Твитчеля). В последнем случае жирные кислоты выделяются в свободном виде, легко отделяются от глицерина и уже потом перерабатываются действием щелочей (едкий натр, сода) на мыло или используются для других целей.
Моющее действие мыла основано на сложных физико-химических процессах. Являясь солью слабой кислоты и сильного основания, мыло в воде подвергается гидролизу:
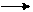
 С17Н35СООNа + Н2О С17Н35СООН + NаОН
С17Н35СООNа + Н2О С17Н35СООН + NаОН
Выделяющаяся при гидролизе щелочь в некоторой степени обусловливает моющее действие мыла, однако главную роль играют процессы эмульгирования, связанные с изменением поверхностного натяжения воды под действием мыла.
Для получения мыла расходуются значительные количества жиров. Сокращение расходов пищевого сырья для технических целей достигается двумя путями. Во-первых, высокомолекулярные жирные кислоты, необходимые для производства мыла, получают не только из жиров, но и окислением парафина – смеси высокомолекулярных углеводородов, выделяемых из нефти. Окисление проводят, продувая воздух через расплавленный парафин при температуре около 100оС. катализаторами служат окислы марганца.
Второй путь уменьшения расхода жиров на технические нужды – замена мыла другими моющими средствами.
Синтетические моющие средства.
Основу синтетических моющих средств составляют поверхностно-активные (обладающие способностью понижать поверхностное натяжение) органические вещества, характерной структурной особенностью которых является наличие длинной углеродной цепи и ионогенной группы. Последняя чаще всего представляет собой соль сульфокислоты. Такие вещества можно получить, например, одновременным действием хлора и сернистого газа (сульфохлорирование) на парафиновые углеводороды с 10-14 углеродными атомами и последующей обработкой полученных сульфохлоридов щелочами:
 С10Н22+SО2+Сl2 С10Н21SО2Cl+HCl
С10Н22+SО2+Сl2 С10Н21SО2Cl+HCl
 C10H21SO2Cl+2NaOH C10H21SO2ONa+NaCl+H2O
C10H21SO2Cl+2NaOH C10H21SO2ONa+NaCl+H2O
В качестве сырья используют также ароматические углеводороды с длинной боковой цепью, подвергая их действию хлорсульфоновой кислоты:
HSO3Cl NaOH
 C8H17 – C6H5 C8H17 – C6H4 – SO3H C8H17 – C6H4 – SO3Na
C8H17 – C6H5 C8H17 – C6H4 – SO3H C8H17 – C6H4 – SO3Na
Соли кислых сульфатов высокомолекулярных спиртов также являются поверхностно-активными веществами:
SO3 NaOH
 C12H25OH C12H25OSO3H C12H25OSO3Na
C12H25OH C12H25OSO3H C12H25OSO3Na
Перечисленные типы соединений образуют класс анионоактивных поверхностно-активных веществ, поскольку главную роль в них играет органический анион. В качестве катиона в состав таких поверхностно-активных веществ может входить не только натрий, но и калий, аммоний, органические основания – амины. Анионоактивные соединения – самый распространенный тип поверхностно-активных веществ.
Органический остаток может существовать также и в виде катиона, чаще всего в форме четвертичной аммониевой соли [R4N]+X-. Подобные вещества называют катионоактивными. Третий тип поверхностно-активных веществ содержит в органическом остатке как катионную, так и анионную группу. Такие вещества относятся к числу амфотерных. Наконец, известны и неионогенные поверхностно-активные вещества.
Моющие средства, используемые на практике, помимо того или иного вида поверхностно-активных веществ, содержат различные добавки, способствующие усилению моющего действия, это некоторые неорганические вещества щелочного характера (сода, различные фосфаты и др.). Кроме того, добавляют вещества, способствующие стабилизации пены, оптические отбеливатели (органические соединения, преобразующие поглощенный ими ультрафиолетовый свет в видимый голубой, повышая тем самым белизну ткани).
Современные синтетические моющие вещества не только являются полноценными заменителями мыла, но и превосходят его по некоторым свойствам. Так, обычное мыло теряет свое моющее действие в жесткой или морской воде. Происходит это из-за образования нерастворимых кальциевых солей жирных кислот:
 2С17H35COONa+Ca(HCO3)2 (C17H35COO)2Ca+2NaHCO3
2С17H35COONa+Ca(HCO3)2 (C17H35COO)2Ca+2NaHCO3
Синтетические моющие средства не обладают этим недостатком. Кроме того, из-за своей меньшей щелочности они меньше разрушают ткань. Все это привело к тому, что ныне производство синтетических моющих средств достигло больших размеров.
Отмечено вместе с тем и нежелательное побочное действие синтетических моющих средств: когда вода, содержащая их, в больших количествах попадает в реки, это вызывает сильное образование пены и ухудшает условия существования рыб и других обитателей рек. Поэтому сейчас стремятся выпускать моющие средства сравнительно нестойкие, легко подвергающиеся деструкции в природных условиях, биологическому разрушению. Такими свойствами прежде всего обладают алкилсульфонаты, в меньшей степени – алкилсульфаты. Хуже всего в этом отношении алкилбензолсульфонаты с разветвленной углеводородной цепью.
Контрольные вопросы:
1. Вредное действие метанола и этанола на организм человека.
2. Ядовитость спиртов.
3. Применение спиртов.
4. Как используются фенолы?
5. Охрана окружающей среды от загрязнения фенолов.
6. Реакции Кучерова.
7. Применение карбоновых ксилот.
8. Какие свойства уксусной кислоты позволяют зачислить ее к кислотам?
9. Какая группа атомов определяет физические и химические свойства карбоновых кислот?
10. Эстеры.
11. Биологическая роль жиров.
12. Чем пахнут эстеры?
 2020-09-24
2020-09-24 253
253







