1. Сформулируйте основные положения МКТ.
2. Размеры наиболее крупных атомов и молекул.
3. Сравнение с обычными размерами.
4. Броуновское движение.
5. Оценка вил взаимодействия молекул.
6. Строение жидкостей, газов и твердых тел.
Тема 13: Газовые законы
План:
- Идеальный газ.
- Основное уравнение МКТ.
- Температура и ее измерение.
- Газовые законы.
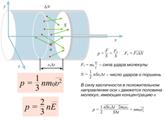
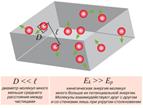 Вопрос 1. Идеальный газ. Идеальный газ – газ, атомы которого находятся на очень больших расстояниях и практически не взаимодействуют. Идеальный газ − газ, для которого взаимодействием и размерами молекул можно пренебречь. При достаточном разрежении (например, воздух при обычных, близких к нормальным условиям) газы с хорошей точностью описываются этой моделью. Молекулы представляются в виде маленьких упругих шариков, которые, не задевая друг друга, летают по всему предоставленному объему и, изменяя свой импульс при ударах о стенки, оказывают на них давление.
Вопрос 1. Идеальный газ. Идеальный газ – газ, атомы которого находятся на очень больших расстояниях и практически не взаимодействуют. Идеальный газ − газ, для которого взаимодействием и размерами молекул можно пренебречь. При достаточном разрежении (например, воздух при обычных, близких к нормальным условиям) газы с хорошей точностью описываются этой моделью. Молекулы представляются в виде маленьких упругих шариков, которые, не задевая друг друга, летают по всему предоставленному объему и, изменяя свой импульс при ударах о стенки, оказывают на них давление.
Вопрос 2. Основное уравнение МКТ. Основное уравнение молекулярно-кинетической теории газов связывает микро- и макропараметры, характеризующие газовую систему:
Вопрос 3. Температура и ее измерение. Температура – это степень нагретости тел. Т емпература — это физическая величина, которая является количественной мерой средней энергии теплового движения молекул газа.Действие приборов для измерения температуры базируется на различных физических эффектах. Наиболее распространены жидкостные (спиртовые и ртутные) термометры, в основе действия которых лежит тепловое расширение жидкостей. Есть также термометры газовые (термометры давления), электрические (термометры сопротивления) и др.
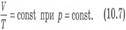
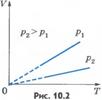

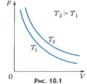
 Вопрос 4. Газовые законы. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греческого слова «изос» - равный). Изотермический процесс. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим. Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно. Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой. Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческого слова «барос» - вес) Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.:
Вопрос 4. Газовые законы. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греческого слова «изос» - равный). Изотермический процесс. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим. Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно. Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой. Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческого слова «барос» - вес) Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.: 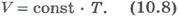 Эта зависимость графически изображается прямой, которая называется изобарой Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным (от греческого слова «хорема» - вместимость). Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Согласно уравнению (10.9) давление газа при постоянном объеме пропорционально температуре:
Эта зависимость графически изображается прямой, которая называется изобарой Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным (от греческого слова «хорема» - вместимость). Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Согласно уравнению (10.9) давление газа при постоянном объеме пропорционально температуре:  Эта зависимость изображается прямой, называемой изохорой
Эта зависимость изображается прямой, называемой изохорой
 2020-09-24
2020-09-24 160
160








