Зрительный процесс включает в себя довольно много стадий, из которых только первые, не представляющие собой зрения в смысле восприятия изображения, можно описать как молекулярные процессы.
Световые импульсы, как уже было замечено, воспринимаются фоторецепторами (палочками и колбочками) и затем передаются в центральную нервную систему. Рассмотрим подробнее процессы, ведущие к появлению зрительного сигнала в палочке.
Г. Вальд показал, что для цикличного процесса фоторецепции необходим зрительный пурпур (родопсин), состоящий из гликопротеина опсина и связанной с ним хромофорной группы 11-цис-ретиналя, который представляет из себя альдегидную форму витамина А. Вообще говоря активным компонентом, поглощающим свет видимой области, является ретиналь, который по химической структуре представляет собой полиеновую цепь из шести чередующихся одинарных и двойных связей. Хромофорную функцию в родопсине выполняет только изогнутая молекула 11-цис-ретиналя. Ретиналь же соединяется с опсином только тогда, когда ретиналь изогнут, поскольку он внедряется в «нишу», имеющуюся в опсине; хромофор и белковая часть соединяются ковалентной связь между альдегидной группой ретиналя и аминогруппой остатка лизина седьмого гидрофобного участка полипептидной цепи. Подобная структура может как легко присоединять атомы водорода, так и легко отдавать их.
Поглощение фотона 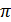 -электронами сопряжённых двойных связей ретиналя вызывает переход молекулы на более высокий энергетический уровень и её сильные колебания. При этом с вероятностью 50-65% происходит стереоизомеризация ретиналя – переход из изогнутой 11-цис формы в полностью выпрямленную транс-форму. Поворот происходит за время около 1 пс за счёт поворота атомов вокруг двойной связи; причём энергии, содержащейся в одном кванте света, достаточно для изменения пространственного положения атомов. Во время фотопревращения родопсин обесцвечивается. Комплекс дестабилизируется – нарушается комплементарность между формой активного центра опсина и формой ретиналя – и в несколько этапов разрывается с образованием в конечном итоге ретинола и опсина. Синхронные конформационные изменения молекул родопсина в зрительном пигменте генерируют первичный рецепторный потенциал (также называемый ранним – РРП). После происходит как темновое, так и световое восстановление родопсина: отделившийся от опсина транс-ретиналь поступает в пигментный эпителий сетчатки, подвергается ряду превращений и при участии ферментов доставляется к фоторецепторам в виде цис-формы.
-электронами сопряжённых двойных связей ретиналя вызывает переход молекулы на более высокий энергетический уровень и её сильные колебания. При этом с вероятностью 50-65% происходит стереоизомеризация ретиналя – переход из изогнутой 11-цис формы в полностью выпрямленную транс-форму. Поворот происходит за время около 1 пс за счёт поворота атомов вокруг двойной связи; причём энергии, содержащейся в одном кванте света, достаточно для изменения пространственного положения атомов. Во время фотопревращения родопсин обесцвечивается. Комплекс дестабилизируется – нарушается комплементарность между формой активного центра опсина и формой ретиналя – и в несколько этапов разрывается с образованием в конечном итоге ретинола и опсина. Синхронные конформационные изменения молекул родопсина в зрительном пигменте генерируют первичный рецепторный потенциал (также называемый ранним – РРП). После происходит как темновое, так и световое восстановление родопсина: отделившийся от опсина транс-ретиналь поступает в пигментный эпителий сетчатки, подвергается ряду превращений и при участии ферментов доставляется к фоторецепторам в виде цис-формы.
Стадии, описанные выше, можно сопроводить наглядным рисунком:
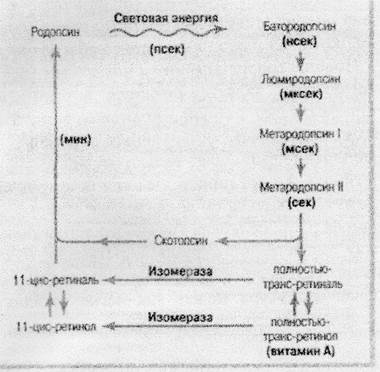
Рисунок 6. Зрительный цикл родопсина и ретиналя.
В этом рисунке демонстрируется не только распад родопсина под действием светового излучения, но также его медленное восстановление в ходе химических реакций.
Физиологический смысл фотохимических превращений родопсина состоит в трансформации светового сигнала в электрический при многократном усилении. В этот процесс вовлечены как внешняя, так и внутренняя мембраны фоторецепторной клетки, мембранный потенциал которой составляет около -45 мВ в темноте, когда палочка не возбуждена. Такая величина мембранного потенциала говорит о сниженной электроотрицательности внутренней стороны мембраны, так как для большинства сенсорных рецепторов характерна величина мембранного потенциала (-70) 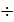 (-80) мВ.
(-80) мВ.
Мембрана наружного сегмента клетки в темноте хорошо проницаема для ионов натрия, но плохо проницаема для ионов калия; для внутреннего сегмента наблюдается противоположная ситуация. Таким образом, в темноте через натриевые каналы наружного сегмента по направлению электрохимического градиента внутрь палочки входят ионы натрия. Они активно выбрасываются в окружающую среду калий-натриевым насосом, в связи с чем их концентрация внутри клетки поддерживается на низком уровне. Поступившие в клетку ионы калия пассивно выходят через мембрану внутреннего сегмента.
При поглощении фотона натриевые каналы в мембране наружного сегмента фоторецептора блокируются, поток ионов натрия уменьшается: ионы натрия продолжают выкачиваться наружу через мембрану внутреннего сегмента АТФ-азой, но число покидающих ионов превышает число поступающих. Это блокирование и является одним из факторов, определяющих усиление сигнала. Закрытие натриевых каналов гиперполяризует мембранный потенциал: положительный заряд ионов натрия способствует увеличению отрицательности с внутренней стороны мембраны, и, чем больше света падает на палочку, тем выше становится электроотрицательность. Из-за гиперполяризации фоторецептор выделяет меньше возбуждающего нейротрансмиттера глутамата, и в биполярной клетке, которая «растормаживается», появляется нервный импульс.
Натриевые каналы и молекулы родопсина в дисках пространственно не связаны, в связи с чем управление состоянием каналов возможно с помощью молекул медиатора, диффундирующих в цитоплазме фоторецептора. В качестве медиатора могут выступать ионы кальция или циклический гуанозинмонофосфат (цГМФ), в связи с чем получили распространение две гипотезы.
Первая гипотеза основана на накоплении ионов кальция, связанных в мембранных дисках, их активации при поглощении света и диффундировании из дисков в плазматическую мембрану наружного сегмента палочки (в случае колбочек происходит диффундирование ионов из одного участка плазматической мембраны в другой), что приводит к блокаде натриевых каналов. Так как проводимость мембраны для мелких ионов уменьшается, она гиперполяризуется, возникает вторичный (поздний) рецепторный потенциал – ПРП. ПРП представляет собой изменение мембранного потенциала рецептора, в темноте он составляет (-25) 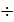 (-40) мВ. Чем больше интенсивность светового стимула, тем выше амплитуда ПРП, причём временная инерция колбочек меньше, чем у палочек. Коррелированность ПРП с интенсивность светового стимула выражается формулой (законом Геринга):
(-40) мВ. Чем больше интенсивность светового стимула, тем выше амплитуда ПРП, причём временная инерция колбочек меньше, чем у палочек. Коррелированность ПРП с интенсивность светового стимула выражается формулой (законом Геринга):
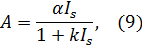
где А – амплитуда ПРП;
IS – интенсивность светового стимула (число фотонов, падающих на единицу площади в единицу времени);
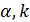 – константы, которые меняются вместе с длиной волны монохроматического света.
– константы, которые меняются вместе с длиной волны монохроматического света.
Это уравнение можно записать в иной форме:
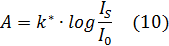
где k* – некая константа;
I0 – пороговая интенсивность стимула, зависящая от уровня адаптации.
Тогда формула (10) представляет собой не что иное, как закон Вебера-Фехнера. Это – психофизический закон, который заключается в том, что интенсивность ощущения пропорциональна логарифму интенсивности стимула, то есть новый раздражитель для сенсорного отличия от предыдущего должен отличаться на некоторую величину, пропорциональную для исходного раздражителя. Если IS<I0, то стимул не ощущается вовсе. Закон обуславливается тем, что константы скорости химических реакций, имеющих место при рецептировании, нелинейно зависят от концентрации химических раздражителей или химических посредников физических раздражителей.
Вторая гипотеза, более поздняя, основана на представлении о высокой проводимости мембраны для натрия в темноте и, следовательно, прохождении через неё так называемого «темнового тока» (поток ионов в темноте, который был открыт У. Хейгинсом, Р. Пенном и Ш. Йосиками). Эта проводимость зависит от цГМФ: в темноте высокое содержание этого медиатора поддерживает натриевые каналы открытыми; в то время как воздействие светом вызывает превращение родопсина и активацию множества молекул фермента трансдуцина, который посредством активации молекул фермента фосфодиэстеразы гидролизует цГМФ и уменьшает его концентрацию, и цГМФ-зависимые натриевые каналы закрываются (при распаде родопсина происходит блокада около 10 тысяч таких каналов). Уменьшение тока ионов натрия вызывает возбуждение палочки. Затем, в течением примерно 1 секунды другой фермент, который всегда есть в палочке – родосинкиназа – инактивирует активированный родопсин (метародопсин II), и весь каскад возвращается к исходному нормальному состоянию с открытыми натриевыми каналами. Активацию трансдуцина, который разрушает цГМФ, объясняют конформацией белковой части родопсина.
Обе эти теории не имеют однозначных экспериментальных подтверждений, однако участие цГМФ и ионов кальция в управлении состояния натриевых каналов и внутриклеточной передаче сигналов не подвергается сомнениям.
Список литературы:
1. Хьюбел, Д. Глаз, мозг, зрение: Пер. с англ. – М.: Мир, 1990. – 236 с., ил. – с. 44, 46, 48, 56, 169-172, 175-168.
2. Тамарова, Р. М. Оптические приборы для исследования глаза. – М.: Медицина, 1982. – с. 5-12, 15-16, 18-21, 28.
3. Болсунов, К. Н. Биофизика: Учеб.-метод. комплекс / К. Н. Болсунов, Е. В. Садыкова, Б. И. Чигирев. – СПб.: Изд-во СПбГЭТУ «ЛЭТИ», 2011. – с. 103-111, 113.
4. Физиология человека: В 3-х томах. Т.1. Пер. с англ. / Под. ред. Р. Шмидта и Г. Тевса. – 3-е изд. – М.: Мир, 2005. – том 1, с. 239, 248-250, 269-272.
5. Ревин, В. В. Биофизика: Учеб. / В. В. Ревин, Г. В. Максимов, О. Р. Кольс; Под ред. проф. А. Б. Рубина. – Саранск: Изд-во Мордов. ун-та, 2002. – с. 120-121.
6. Рубин, А. Б. Биофизика: учебник для биологических спец.вузов: в 2 т. Т. 2. – 2-е изд., испр. и доп. – М.: Университет, 1999. – с. 410, 415, 417.
7. Гайтон, А. К. Медицинская физиология / А. К. Гайтон, Дж. Э. Холл / Пер. с англ.; Под ред. В. И. Кобрина. – М.: Логосфера, 2008. – с. 699-702.
 2020-09-24
2020-09-24 166
166







