Вслед за щелочным плавлением арилсульфонатов был предложен более простой и доступный метод получения фенолов из арилгалогенидов замещением галогена на гидроксил. Арилгалогениды, не содержащие активирующих электроноакцепторных группировок, вступают в реакцию обмена в очень жестких условиях. Однако при нагревании хлорбензола с 15-20%-ным водным раствором гидроксида натрия при 360-390оС и давлении 28 мПа (280-300атм) образуется фенол. На основании экспериментов с хлорбензолом-I14C было показано, что в этих условиях реакция идет по ариновому механизму. Дегидробензол, образующийся из хлорбензола, превращается в фенол за счет присоединения гидроксид-иона, а при присоединении фенолят-иона дает смесь дифенилового эфира и анионов 2-гидроксибифенила и 4-гидроксибифенила.
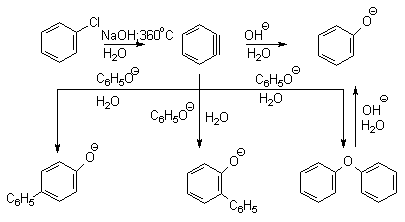
Фенолят-ионы, подобно енолят-ионам, представляют собой типичные амбидентные анионы, у которых заряд делокализован между атомом кислорода и атомами углерода в орто- и пара-положениях бензольного кольца. Образование дифенилового эфира, 2-гидрокси- и 4-гидроксибифенилов объясняется амбидентной природой фенолят-иона. Дифениловый эфир при 360-390оС в водном растворе NaOH необратимо гидролизуется в фенол. 2-Гидрокси- и 4-гидроксибифенилы в отличие от дифенилового эфира не подвергаются гидролизу, их суммарное количество среди смолообразных продуктов реакции составляет 20-25%. Из этого следует, что основным путем стабилизации дегидробензола является захват гидроксид-иона с образованием фенола. Ариновый механизм замещения хлора в неактивированных арилхлоридах на гидроксил под действием гидроксидов щелочных металлов подтверждается также образованием смеси мета- и орто-метилфенолов в соотношении 3:2 из о-хлортолуола, смеси 1- и 2-нафтолов как из 1-хлорнафталина, так и из 2-хлорнафталина. В присутствии солей меди (II), играющих роль катализатора, ариновый механизм полностью подавляется из-за резкого ускорения прямого замещения галогена по SNAr-механизму. Применение солей меди (II) позволяет проводить региоселективное замещение галогена на гидроксил без примеси кокого-либо другого изомерного фенола.
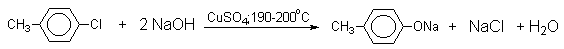
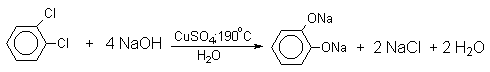
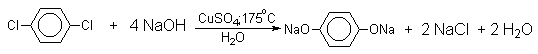
Роль ионов меди в этой реакции до настоящего времени не получила удовлетворительного объяснения.
Введение в молекулу арилгалогенида электроноакцепторных заместителей в орто- или пара-положения увеличивают скорость обмена галогена на гидроксил в некатализируемой реакции. Для такой реакции на основании многочисленных экспериментальных данных предложен SNAr-механизм замещения, хотя  -комплекс Мейзенгеймера не был зафиксирован в процессах обмена галогена на гидроксил.
-комплекс Мейзенгеймера не был зафиксирован в процессах обмена галогена на гидроксил.
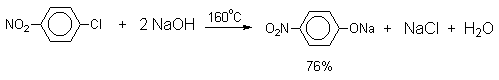
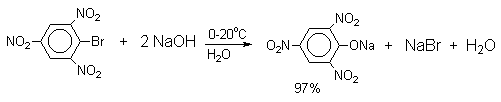
Накопление электроноакцепторных групп позволяет осуществлять замещение в очень мягких условиях, в отдельных случаях гидролиз удается провести в нейтральной среде.
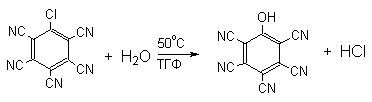
Бимолекулярный механизм присоединения-отщепления SNAr подробно изложен в методической разработке "Реакции нуклеофильного ароматического замещения" (1994, авторы: А.Л.Курц,.и др.)
 2020-09-24
2020-09-24 117
117








