В отличии от простых эфиров для оксиранов характерны реакции расщепления напряженного трехчленного цикла под действием разнообразных нуклеофильных агентов. Раскрытие цикла под действием этих агентов происходит по SN2- механизму строго стереспецифично с обращением конфиругации. Это можно проиллюстрировать на примере раскрытия оксиранового кольца циклогексеноксида под действием гидроксид-иона с образованием исключительно транс-изомера 2-оксициклогексанола.
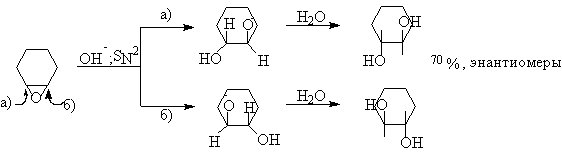
При наличии в оксирановом кольце алкильного или арильного заместителя атака нуклеофильного агента направляется преимущественно по незамещенному, пространственно более доступному атому углерода.
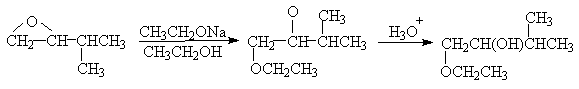
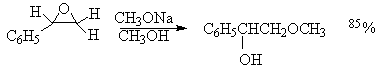
Механизм гидролиза и алкоголиза оксиранов может полностью измениться при проведении реакции в кислой среде или в присутствии электрофильного катализатора. В быстрой и обратимой первой стадии происходит протонирование оксирана по атому кислорода с образованием оксониевого катиона. Во второй медленной стадии протонированная форма подвергается нуклеофильной атаке водой, спиртом или галогенид-ионом. Протонирование оксирана ускоряет раскрытие кольца при взаимодействии с нуклеофильными агентами.
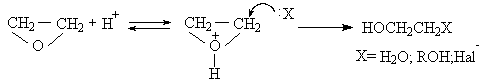
В зависимости от строения оксирана механизм расщепления трехчленного цикла может изменяться от SN2 до SN1. Если в результате раскрытия цикла образуется относительно устойчивый третичный карбокатион, катализируемый кислотой сольволиз оксирана протекает по SN1-механизму.
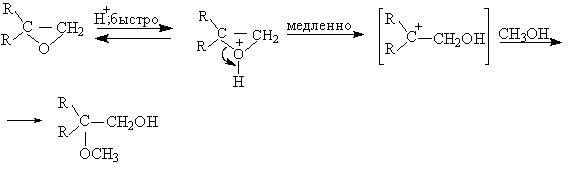
Направление раскрытия оксиранового кольца при SN1-механизме полностью противоположно тому, которое наблюдается при SN2-механизме. Если реализуется SN1-механизм, нуклеофильная атака направляется по наиболее замещенному атому углерода. При конкуренции SN2 и SN1-механизмов раскрытие цикла не отличается высокой региоселективностью и приводит к образованию смеси двух изомерных продуктов сольволитического расщепления кольца оксирана.
Взаимодействие оксиранов с магнийорганическими соединениями следует рассматривать как бимолекулярное нуклеофильное замещение у насыщенного атома углерода оксирана под действием карбоаниона металлоорганического соединения. Раскрытию цикла способствует образование координационого донорно-акцепторного комплекса между атомами кислорода и магния, которое можно рассматривать как электрофильный катализ в реакции нуклеофильного замещения.
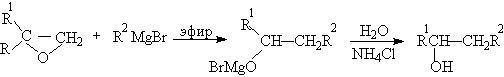
Как следует из приведенного уравнения продуктами этой реакции являются спирты. Оксирановый цикл размыкается также под действием диалкилкупратов, причем замещение происходит при наименее замещенном атоме углерода.
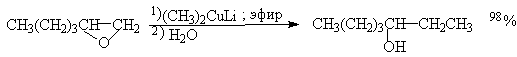
Восстановление оксиранов с помощью алюмогидрида лития, как и следовало ожидать для SN2-механизма, приводит к раскрытию цикла при наименее замещенном атоме углерода с образованием наиболее замещенного спирта.
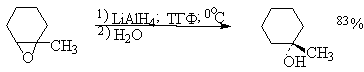
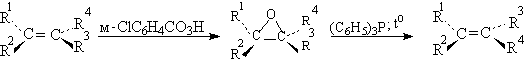
Оксираны иногда применяются в оригинальном способе превращения одного геометрического изомера алкена в другой. Эти взаимопревращения Е- и Z-изомеров алкенов основано на реакции дезоксигенирования (отщепления кислорода) оксиранов в алкены под действием третичных фосфинов. Окисрановый цикл раскрывается в результате нуклеофильной атаки трифенилфосфина с образованием бетаина (биполярного мона). При вращении простой углерод-углеродной связи в бетаине и последующем син-элиминировании трифенилфосфиноксида образуется алкен, конфигурация которого противоположна конфигурации исходного оксирана.
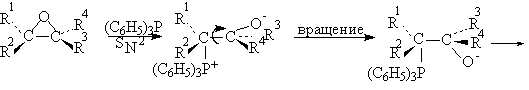
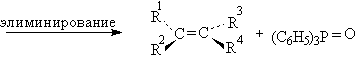
Так как исходный оксиран получается при стереоспецифическом эпоксидировании алкена с помощью перкислот, приведенная ниже последовательность превращений приводит к изменению конфиругации алкена.
Простейший из оксиранов - окись этилена широко используется в промышленности для получения этиленгликоля, диэтиленгликоля, триэтиленгликоля, их моно- и диалкиловых эфиров. Этиленгликоль получают при кислотно-катализируемом гидролизе окиси этилена.
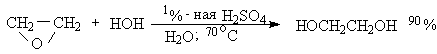
Аналогично из окиси этилена и этиленгликоля получается диэтиленгликоль и затем триэтиленгликоль.
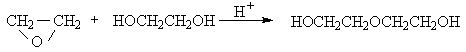
Моноалкиловые (целлозольвы) и диалкиловые (карбитолы) эфиры этиленгликоля, диэтиленгликоля используют в качестве растворителей. Все эти апротонные малополярные растворители обладают превосходной сольватирующей способностью по отношению к катионам щелочных и щелочноземельных металлов.
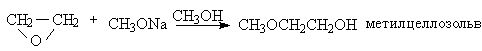
Наиболее важными растворителями, производными гликолей, являются диметиловые эфиры этиленшдиколя (моноглим, диметоксиэтан), диметиловый эфир диэтиленгликоля (диглим), диметиловый эфир тетраэтиленгликоля (тетраглим). Все эти апротонные малополярные растворители обладают превосходной сольватирующей способностью по отношению к катионам щелочных и щелочноземельных металлов и широко используются в реакциях гидроборирования, металлоорганических соедиенний и других самых разнообразных превращений в органической химии. Диметиловые эфиры моно-, ди- и тетраэтиленгликолей получают метилированием их монометиловых эфиров диметилсульфатом в щелочной среде.
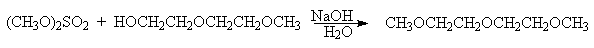
 2020-09-24
2020-09-24 168
168








