хххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххх
Катализ – возбуждение химических реакций или изменение их скорости под влиянием веществ (катализаторов), вступающих в химическое взаимодействие с участниками реакции и восстанавливающихся после каждого цикла химического взаимодействия.
хххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххххх
Катализаторы часто представляют собой многокомпонентные системы, которые могут находиться в различных формах: в виде простых соединений (металлы, угли), оксидов, сульфидов, а также сложных комплексных соединений (ферменты).
Катализатор изменяет механизм реакции на энергетически более выгодный, т.е. снижает энергию активации. Катализаторы не смещают химическое равновесие при обратимых реакциях.

При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, что приводит к снижению энергии активации. В качестве примера – разложение пероксида водорода в присутствии ионов йода (реакция протекает в две стадии):
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела, поэтому активность катализатора зависит от величины и свойств его поверхности. Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Ферментативный катализ: реакции, протекающие с участием ферментов – катализаторов белковой природы.
Снижение энергии активации при ферментативном катализе обусловлено увеличением числа стадий химического процесса. Активация промежуточных реакций приводит к тому, что исходный активационный барьер дробится на несколько более низких барьеров, преодолеть которые реагирующие молекулы могут гораздо быстрее, чем исходный барьер.
Теория Фишера «Ключ – замок».
Теория «Индуцированного соответствия (эластичного активного центра)» Кошланда.
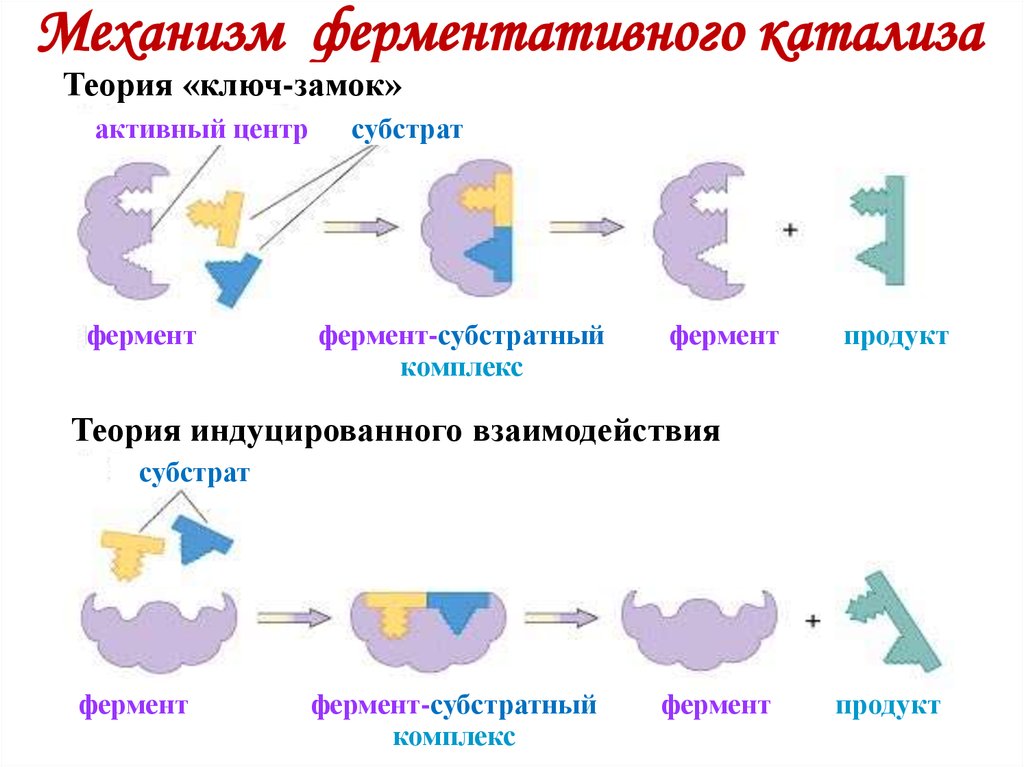
Ферментативный катализ имеет две характерные особенности:
Высокая активность, на несколько порядков превышающая активность неорганических катализаторов (реакция в присутствии фермента может протекать в миллион раз быстрее).
Высокая специфичность (избирательность). Например, амилаза катализирует процесс расщепления крахмала, представляющего цепь глюкозных звеньев, но не катализирует гидролиз сахарозы, составленной из глюкозного и фруктозного фрагментов.
 2020-09-24
2020-09-24 641
641








