Согласно следствию из закона Авогадро, 1 моль любого газа занимает объем 22,4 л. Поэтому, зная массу газа в определенном объеме, можно найти его молярную массу. Пусть g(г) исследуемого газа занимает при н. у. объем Vo(л), то молярная масса определяется как количество газа, занимающее объем 22,4 л, т. е.:
 .
.
Выражение g/V0 представляет массу одного литра газа при н. у., т. е. его плотность Д0. Следовательно, молярная масса газа (М) может быть выражена как произведение его плотности на 22,4 л:

Если объемы газов измерены при температуре и давлении отличных от нормальных, то для вычисления плотности объемы газов необходимо привести к нормальным условиям, используя уравнение состояния идеального газа, объединяющего законы Бойля-Мариотта и Гей-Люссака:
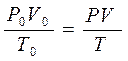 ,
,
где Po – нормальное давление, равное 101,3 кПа;
Vo – объем газа при н. у., выраженный в л; То = 273 К,
Р – парциальное давление сухого водорода, равное измеренному атмосферному давлению минус парциальное давление водяного пара при температуре опыта;
Т – температура опыта, равная То + t0С.
Определение молярной массы газа по относительной плотности (по водороду или воздуху).
Для определения молярной массы газа удобно пользоваться понятием относительной плотности. Рассчитывают молярную массу по уравнениям следствия 3) закона Авогадро.
Пример. Плотность метана по водороду равна 9, а по воздуху 0,62.
Отсюда, молярная масса метана равна 18 г/моль, так как
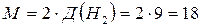 г/моль;
г/моль;
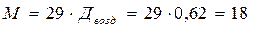 г/моль.
г/моль.
При определении молярной массы газа по относительной плотности не обязательно приводить газ к нормальным условиям.
 2020-09-24
2020-09-24 352
352








