Тепловые эффекты химических реакций. ЭНТАЛЬПИЯ. Закон Гесса
Теоретическая часть
Под системой понимают вещество или группу веществ, изолированных (иногда мысленно) от окружающей среды. Каждая система обладает внутренней энергией (U), которая складывается из энергий, образующих ее частиц (молекул, атомов, электронов, ядер и т. д.): кинетической энергии движения частиц, потенциальной энергии их взаимодействия между собой, собственной энергии, отвечающей массе покоя частиц, энергии связи. Нельзя определить абсолютное значение внутренней энергии, измерить можно только изменение внутренней энергии системы (DU). Согласно первому закону термодинамики, количества тепла (Q), поступающее в закрытую систему, расходуется на изменение внутренней энергии (DU) и совершение ею работы (А):
Q = DU + A.
Если химический процесс протекает при постоянном объеме, то
QV = DU.
Система не совершает работу.
Если химический процесс протекает при постоянном давлении, то
QP = DU + PDV
(PDV – работа расширения системы) или
QP = (U2 – U1) + (pV2 – pV1) = (U2 +pV2) – (U1 + pV1) = DH,
H = U + PV,
где H (энтальпия) – термодинамическая функция состояния системы, изменение которой отвечает тепловому эффекту реакции, протекающей в этой системе при постоянном давлении.
Уравнения химических реакций, в которых указывается тепловой эффект (кДж или ккал) и агрегатное состояние веществ называют термохимическими.
При сопоставлении тепловых эффектов различных химических реакций используют представление о стандартном состоянии исходных веществ и продуктов.
Стандартное состояние: Т = 298 К (25ºС), Р = 101,3 кПа (1 атм.)
Закон Гесса (1836 г.): тепловой эффект химической реакции не зависит от промежуточных стадий, зависит только от начального и конечного состояний.
Закон Гесса позволяет рассчитывать тепловые эффекты реакций, экспериментальное определение которых затруднено. Согласно закону Гесса, можно реакции складывать (вычитать) и соответственно складывать (вычитать) тепловые эффекты этих реакций.
Пример. Зная теплоту сгорания графита до СО2 и теплоту сгорания СО до СО2:
1) С + О2 = СО2, DH10 = –393,5 кДж/моль,
2) СО + 0,5О2 = СО2, DH20 = –283 кДж/моль.
Определите тепловой эффект реакции:
3) С + 0,5О2 = СО, DH30 -?
Решение: DH10 = DH20 + DH30, DH30 = DH10 – DH20 = –393,5 – (–283) = –110,5 кДж.
Ответ: –110,5 кДж.
ВОПРОСЫ К ДОПУСКУ
1. Тепловой эффект химической реакции, эндо- и экзотермические реакции.
2. Понятие энтальпии химической реакции.
3. Почему закон Гесса не противоречит Первому закону термодинамики?
Экспериментальная часть
ОПЫТ №1. В стакан налить немного воды и измерить ее температуру термометром. Затем внести в стакан несколько ложек кристаллов нитрата или роданида калия. Объяснить понижение температуры раствора. Аналогичный опыт провести со щелочью. Чем объяснить разогревание раствора?
ОПЫТ № 2. В предварительно взвешенный калориметрический стакан (рис. 13) налить 300 мл дистиллированной воды.
Взвесить примерно 8 г безводного сульфата меди с точностью 0,01 г. Отметить с точностью до 0,1º температуру воды в калориметре t1. Затем при перемешивании высыпают соль через воронку в воду и отмечают максимальную температуру t2. Приняв теплоемкость раствора и его плотность равными единице и, зная массу раствора (соль + вода) и массу калориметрического стакана, вычислить по формуле количество теплоты, выделившейся в калориметре:
g = (t2 – t1) 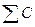 ,
,
где t2 и t1 – конечная и начальная температуры в калориметре,
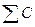 – теплоемкость системы – сумма теплоемкостей калориметрического сосуда и находящегося в нем вещества (раствора) = c1m1 + c2m2,
– теплоемкость системы – сумма теплоемкостей калориметрического сосуда и находящегося в нем вещества (раствора) = c1m1 + c2m2,
c1, c2 – удельные теплоемкости стекла и жидкости,
m1, m2 – массы калориметрического стакана и жидкости, находящейся в калориметрическом сосуде.
Для пересчета теплового эффекта на моль вещества пользуются формулой:
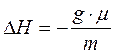 ,
,
где DH – тепловой эффект, рассчитанный на моль,
m – навеска вещества,
μ – молярная масса вещества.
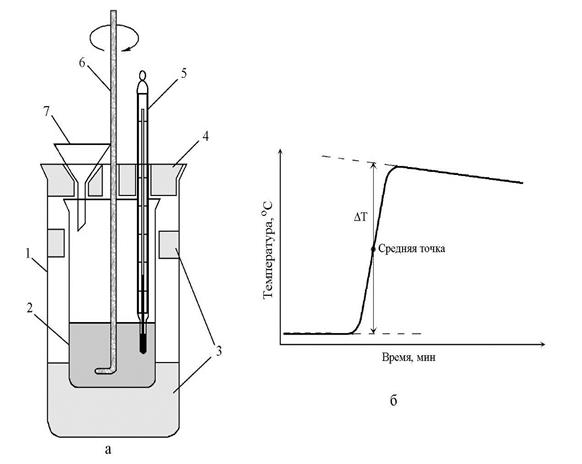
Рис. 13. Калориметр: а – общий вид; б – определение скачка температуры ∆Т; 1, 2 – наружный и внутренний стаканы; 3 – пенопласт; 4 – крышка; 5 – термометр; 6 – мешалка; 7 – воронка
По формуле рассчитать DH растворения безводного сульфата меди.
Для определения энтальпий растворения веществ в воде можно использовать калориметрическую установку. Опыт повторить, взяв кристаллогидрат сульфата меди (навеска равна 10 г) и определить его теплоту растворения DH2. В расчетах берут удельную теплоемкость стекла равной 0,18 кал/град (0,75 Дж/г×град).
Затем рассчитать энтальпию гидратации сульфата меди DHгидр. согласно уравнению:
CuSO4 + 5H2O = CuSO4·5H2O.
Согласно закону Гесса: DHгидр. = DH1 + DH2.
ВОПРОСЫ К ЗАЩИТЕ
1. Что называется теплотой образования химического соединения?
2. Привести примеры применения закона Гесса для химических реакций, протекающих через промежуточные стадии.
3. Какое количество теплоты выделится при сгорании 1 м3 метана, взятого при нормальных условиях, если при сгорании образуются вода и двуокись углерода?
4. Рассчитать энтальпии восстановления оксида хрома (III) алюминием, если известно, что энтальпии образования Cr2O3 и Al2O3 равны соответственно: –1128,6 и –1667,8 кДж/моль.
5. Энтальпии образования NO и NO2 равны соответственно +90,2 и +30,26 кДж/моль. Будет ли реакция 2NO + O2 = 2NO2 экзотермической или эндотермической? Чему равен тепловой эффект реакции?
6. Энтальпии сгорания ацетилена и этана составляют соответственно –1318,3 и –1539,9 кДж/моль. Чему равна теплота гидрирования ацетилена до этана?
7. Теплота образования CdCl2 равна –93,00 ккал/моль, а теплота растворения этого соединения составляет –3,38 ккал/моль. Соответствующие величины для хлористого водорода равны –22,03 и –17,44 ккал/моль. Какое количество тепла выделится при реакции кадмия с водным раствором хлористоводородной кислоты?
 2020-09-24
2020-09-24 351
351








