2) Рассмотрим заполнение уровней у элементов одного периода:
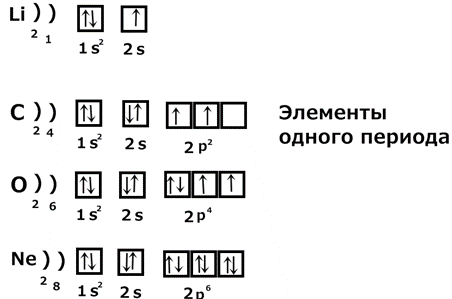
Элементы одного периода имеют одинаковое число электронных оболочек. Это число равно номеру периода.
Физический смысл периодического закона: периодическое изменение свойств химических элементов и их соединений с увеличением порядкового номера объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов.
Периодическая система Д.И. Менделеева – это наглядное графическое изображение периодического закона. Наиболее распространена её так называемая короткопериодная форма.
В структуре таблицы выделяют периоды, группы и подгруппы.
Периодом называют горизонтальную совокупность элементов, расположенных в порядке возрастания заряда ядра. Каждый период начинается s - элементом с конфигурацией внешнего электронного уровня ns1 и завершающийся p - элементом с конфигурацией внешнего электронного уровня ns2np6 (кроме первого периода, который заканчивается гелием – 1s2). Номер периода определяется значением главного квантового числа внешнего электронного уровня. Первые три периода называют малыми и состоят они только из s- и p- элементов. Четыре остальных периода называют большими. В составе четвёртого и пятого периодов появляются d- элементы, а в шестой и седьмой периоды входят f- элементы. В связи с закономерным изменением электронного строения атомов в пределах малых периодов свойства элементов изменяются резко, в больших периодах – медленно.
Группой называют совокупность элементов, расположенных в таблице вертикально в порядке возрастания заряда ядра. В периодической системе находится 8 групп т.к. на внешнем электронном уровне не может быть больше восьми валентных электронов. Каждая группа состоит из главной и побочной подгрупп. В состав главных подгрупп входят только s- или p- элементы, а побочных – d- и f- элементы.
Просматривается четкая связь между электронной структурой атомов и его положением в таблице:
1) номер элемента совпадает с положительным зарядом ядра, числом протонов и электронов;
2) номер периода показывает число электронных оболочек или уровней и значение главного квантового числа;
3) номер группы показывает число электронов на внешнем уровне. Они находятся для s- и p- элементов на последнем уровне, для d- элементов на последнем и предпоследнем уровне;
4) элементы главных и побочных подгрупп отличаются по заполнению электронных оболочек (у главных подгрупп заполняются s- и p- уровни, у побочных d- и f- уровни);
5) высшая валентность по кислороду равна номеру группы;
 2020-09-24
2020-09-24 190
190








