В истории открытия и развития периодического закона можно выделить три основных этапа:
1) XIX век. Растет количество открытых химических элементов, определяются их атомные массы. К этому времени были известны 63 элемента, введено понятие валентность, изучены формы и свойства соединений элементов. Систематизация растущего фактического материала становилась актуальной задачей.
Делалось много попыток создать некую систему элементов, расположив их по возрастанию атомных масс и разделив на колонки. Деберейнер (1829) делил элементы на триады - Ма(среднего члена)»[Ма(кон)-Ма(нач)]/2. В 1862 г. Шанкуртуа выступил с системой элементов, представленной в виде графика «винтовая линия Шанкуртуа», в которой разместил элементы в порядке возрастания атомной массы по винтовой линии, описанной вокруг цилиндра. Сходные элементы располагались друг под другом. Ньюлендс (1863 г.) создает «закон октав», в котором свойства элементов повторяются подобно октавам в музыке. В 1864 г. Мейер опубликовал таблицу, в которой 44 из известных тогда 63 элементов были расположены в порядке возрастания атомных масс в шести столбцах в соответствии с их высшей валентностью по водороду.
Д.И.Менделеев (1869) сформулировал открытый им закон следующим образом: «Свойства элементов, а так же форма и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов».
Заслуги Д.И.Менделеева.
1. Он рассматривал периодичность не одного какого-либо свойства, а всех свойств - химических и физических (в отличие от предшественников).
2. Он ввел длинные ряды и периоды - таблица не представляет собой аккуратного прямоугольника, что предусматривает возможности дальнейшего развития. 1895 - открыты инертные газы.
3. Он оставил пустые клетки в таблице, которые позднее были заполнены вновь открытыми элементами, причем их свойства с большой точностью совпадают с предсказанными Д.И.Менделеевым.
Экабор - скандий, 1879, Нильсен
Экаалюминий - 1875, галлий, Лекок де Буабодран
Экасилиций - 1885, германий, Винклер
4. Исправил атомные веса некоторых элементов, что потом было подтверждено экспериментально (Cr, In, Pt, Au, U)
5. Переставил некоторые элементы местами вопреки некоторой немонотонности в изменении атомных масс (никто еще не подозревал тогда о существовании изотопов). Te (127.60) он поставил перед иодом (126.90). А открытый гораздо позднее аргон (39.94) поставил в группу инертных газов перед калием (39.1).
2) Второй этап. Начало XX века – революция в области физики.
1896 г. А. Беккерель обнаруживает явление радиоактивности у соединений урана. Мария и Пьер Склодовские-Кюри обнаружили радиоактивность и у соединений тория, а в 1898 г. они открыли в составе урановых руд присутствие двух новых радиоактивных элементов – полония и радия. Опыты супругов Кюри показали, что атомы радия в процессе радиоактивного излучения распадаются, превращаясь в атомы других элементов, в частности, в атомы гелия. Впоследствии было установлено, что другим продуктом распада радия является инертный газ радон.
1897 г, Томпсон открывает электрон и в 1903 г создает первую модель атома «сливовый пудинг». Развивая эти представления, Э. Резерфорд в 1911г. предложил ядерную модель строения атома. Существенным шагом в развитии представлений о строении атома стала предложенная в 1913 г. Н. Бором теория, объединившая ядерную модель атома с квантовой теорией света. Основные положения своей теории Бор сформулировал в виде следующих постулатов: 1) электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам); 2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии; 3) Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
В 1913г Мозли изучая спектры атома установил, что положительный заряд ядра равен порядковому номеру элемента (Z = Nэл). В 1923г Д. Иваненко и В. Гейзенберг предложили протонно-нейтронную теорию строение ядер атома. Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов. Наличие изотопов позволило объяснить порядок расположения в таблице некоторых элементов: Ar – K; Te – I; Ca-Ni.
Современная формулировка периодического закона – свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома или порядкового номера элемента.
Почему заряд ядра определяет химические свойства элементов? При увеличении заряда на единицу в ядре появляется новый протон, а на орбитали новый электрон, который располагается на внешнем энергетическом уровне. Числом электронов на внешнем уровне определяется валентность элементов.
3) 3 этап. 20-е годы XX века – Развитие квантовой механики и квантовой физики. Основоположники: Макс Планк, В. Гейзенберг, Нильс Бор, Де Броль. Еще в 1900 г. М. Планк предположил, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно. При этом, он определил энергию каждой такой порции как Е=h∙n (уравнение Планка), где n – частота излучения; h=6,626∙10-34 Дж∙с – постоянная Планка. Т.о., согласно определению Планка, квант – это минимальная порция электромагнитного излучения с определенной частотой. В 1905 г. А. Эйнштейн при изучении явления фотоэффекта пришел к выводу, что электромагнитная энергия существует только в форме квантов, а излучение представляет собой поток неделимых материальных частиц - фотонов, энергия которых определяется уравнением Планка. Фотон не является ни частицей, ни волной – ему свойственна корпускулярно-волновая двойственность.
Де Броль показал, что электрон имеет двойственную природу волны и частицы, для него характерны явления интерференции и дифракции. Был сформулирован принцип неопределенности Гейзенберга – невозможно одновременно точно указать местоположение и скорость движения электрона, если мы знаем, где он находится, то не знаем, с какой скоростью он движется, и наоборот. Электрон не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных точках пространства. Атомная орбиталь – это часть атомного пространства в которой вероятность нахождения данного электрона наибольшая (≈ 90%).
Атомные орбитали – часть атомного пространства, вероятность нахождения данного электрона наибольшая (примерно 90%)
Квантовые числа.
Для характеристики орбиталей используют квантовые числа: n, ℓ, m, s.
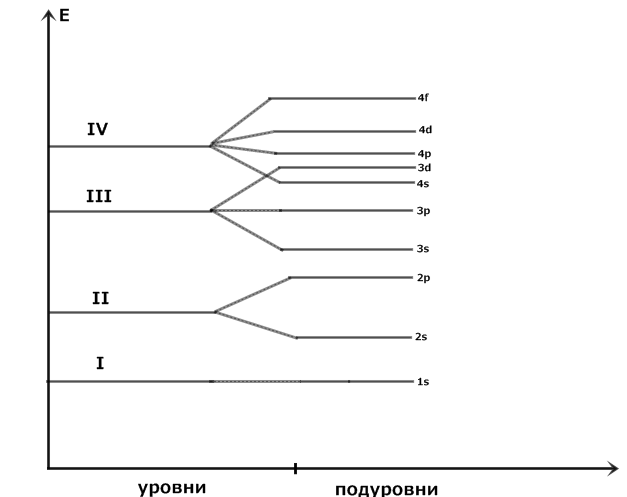
1) n – главное квантовое число характеризующее энергию и размер орбиталей, определяет число электронов на уровне N = 2n2. Принимает значения n= 1,2,3,4…….∞ – все целые числа от 1 до бесконечности. Совокупность орбиталей с одинаковым значением n – энергетический уровень, n равно номеру периода.
2) ℓ – побочное орбитальное квантовое число. Характеризует форму облаков и орбиталей. Принимает значения от 0 до n-1.
Таблица 1. Связь главного (n) и побочного (l) квантовых чисел.
| Уровень | n | ℓ |
| I II III IV | 1 2 3 4 | 0 0,1 0,1,2 0,1,2,3 |
1) ℓ = 0 Орбиталь имеет имеет форму шара. Это s -орбиталь. Имеется на всех энергетических уровнях.

2) ℓ = 1 Орбиталь имеет имеет форму гантели.. Это p -орбиталь. Имеется на всех энергетических уровнях, кроме первого.
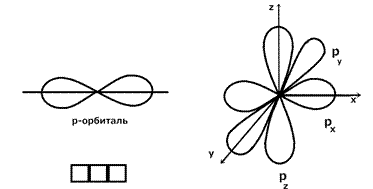
3) ℓ = 2 Это d -орбиталь. Появляется на третьем энергетическом уровне.
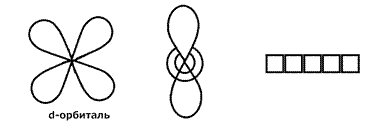
4) ℓ = 3 Это f -орбиталь. Появляется на четвертом энергетическом уровне.
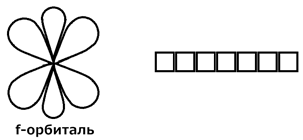
Энергетические уровни состоят из подуровней, число подуровней равно главному квантовому числу.
3) m – магнитное квантовое число. Характеризует направление орбиталей в пространстве и число орбиталей на подуровнях. Принимает значения от – ℓ до + ℓ (одно значение – одна квантовая ячейка.)
s: ℓ =0, m=0 [_]
p: ℓ =1, m= -1, 0, +1 [_|_|_]
d: ℓ =2, m= -2 -1 0 +1 +2 [_|_|_|_|_]
f: ℓ =3, m= -3 -2 -1 0 +1 +2 +3 [_|_|_|_|_|_|_]
4) S – спиновое квантовое число. Характеризует вращение электрона вокруг оси. Принимает 2 значения +1/2 (вращается влево) и -1/2 (вращается вправо)
S+1/2↑ S-1/2↓
Правила заполнения орбиталей:
1) Принцип запрета Паули – в атоме не может быть двух электронов у которых все 4 квантовых числа одинаковы, поэтому на каждой орбитали может быть не более 2-х электронов с антипараллельными спинами.
2) Правило Хунда – в основном состоянии атом должен иметь максимально возможное число неспаренных электронов в пределах одной орбитали.
3) Принцип наименьшей энергии. В основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной, поэтому электроны заполняют уровни в порядке возрастания их энергии
4) Правило Клечковского прежде всего заполняются орбитали с меньшим значением суммы n + ℓ.
Объяснение, почему 4s заполняется раньше, чем 3d:
4s: n =4; ℓ =0 n + ℓ = 4
3d: n =3; ℓ =2 n + ℓ = 5
Поэтому первым заполняется 4s уровень.
Примеры заполнения уровней:
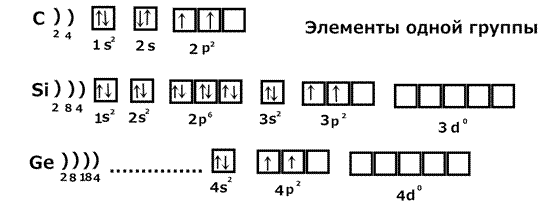
1) Рассмотрим заполнение уровней у элементов одной группы:
 2020-09-24
2020-09-24 227
227








