В водной среде комплексные соединения являются электролитами. Их диссоциация протекает ступенчато.
1-я ступень: идет диссоциация на комплексный ион и ионы внешней сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6] 3-
На этой ступени комплексные соединения сильные электролиты.
2-я ступень: идет разрушение комплексного иона:
[Fe(CN)6] 3- → Fe3+ + 6CN-
На этой ступени комплексные соединения слабые электролиты.
Диссоциацию комплексных соединений характеризует величина константы нестойкости (Кн).
Кн = [Fe3+] ∙ [CN-]6 / [Fe(CN)6] 3-
Чем меньше константа нестойкости, тем устойчивее комплексное соединение. Данные по константам нестойкости приведены в таблицах.
K4[Fe(CN)6] Кн = 1.3 ∙10-37
K2[Co(CNS)4] Kн = 1∙10-2
Следовательно I комплекс устойчивее II.
Изомерия комплексных соединений
1) Ионизационная [Co(NH3)5Br]SO4 - [Co(NH3)5SO4]Br
2) Координационная [Co(NH3)6] [Cr(C2O4)3] - [Cr (NH3)6] [Co(C2O4)3]
3) Связевая [(NH3)5Co-NO2]Cl2 - [(NH3)5Co-ONO]Cl2
4) Гидратная [Cr(H2O)6]Cl3 - [Cr(H2O)5Cl]Cl2×H2O
5) Пространственная - цис- транс- изомерия

6) Оптическая изомерия. Оптические изомеры отличаются друг от друга как правая и левая перчатки, не могут быть совмещены никакими перемещениями в пространстве и вращают плоскость поляризации света в разные стороны. Zn(Gly)2 - (Gly) - глицинат-анион NH2CH2COO-
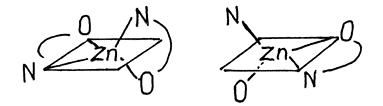
Электронное строение комплексных соединений
В настоящее время для объяснения образования, строения и свойств комплексных соединений применяются три теории.
 2020-09-24
2020-09-24 113
113








