Чтобы определить, является ли элемент в соединении окислителем или восстановителем, удобно пользоваться шкалой степеней окисления элементов.
Шкала степени окисления (ШСО) – это цифровая шкала, на которой проставлены все численные значения степени окисления элемента.
Каждый элемент имеет свою шкалу. Рассмотрим, например, шкалу степеней окисления серы ШСО(S):
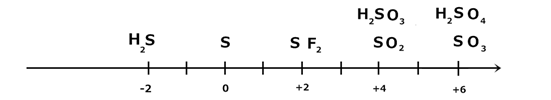
1) H2S – может быть только восстановителем (степень окисления серы может только повышаться);
2) SO3, H2SO4– могут быть только окислителями (степень окисления серы может только понижаться);
3) S, SO2– могут быть как окислителями, так и восстановителями.
Пример 2. Шкала степеней окисления азота ШСО(N):
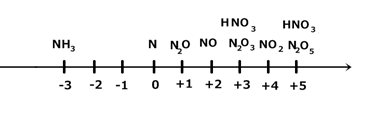
1) NH3 - может быть только восстановителем.
2) HNO3- – может быть только окислителем.
3) N2,N2O,NO,HNO3,NO2 – могут быть как окислителями, так и восстановителями.
Вывод: элементы в своей высшей степени окисления проявляют только окислительные свойства, а в низшей степени окисления проявляют только восстановительные свойства. Элементы, имеющие промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства.
Лучшие восстановители щелочные металлы (Fr)
Лучшие окислители – галогены, особенно F
Классификация ОВР
ОВР делятся на 3 группы:
1. Внутримолекулярные реакции (окислитель и восстановитель в составе одного вещества.)
2. Межмолекулярные реакции (окислитель и восстановитель в составе разных веществ)
3. Реакции диспропорционирования – это реакции, в которых происходит окисление и восстановление одного и того же элемента
Примеры:
1. 2NaN+5O3-2→ 2NaN+3O2 + O20
N+5 +2e → N+3 | 2 окислитель, восстанавливается
2O2-- 4e → O20 | 1 восстановитель, окисляется
2. Zn +2 HCl → ZnCl2 + H2
Zn0 -2e → Zn+2 | 1 восстановитель, окисляется
2H+ +2e → H20 | 1 окислитель, восстанавливается
3. 2H2S-2 + H2S+4O3 → 3S0 + 3H2O
S-2 - 2e→ S0 | 2 восстановитель, окисляется
S+4 + 4e →S0 | 1 окислитель, восстанавливается.
Эквивалент окислителя и восстановителя
Эквивалентом окислителя называют такое количество окислителя, которое отвечает одному присоединенному электрону в данной ОВР. Эквивалентом восстановителя называется такое количество восстановителя, которое отвечает одному отданному электрону в данной ОВР.
Молярная масса эквивалента М(1/z X) окислителя или восстановителя равна:
М(1/z X) = М/n
M – молярная масса окислителя или восстановителя;
n – число отданных или принятых электронов.
Для примера 3:
М(1/z X) окислителя H2SO3 = 82/4 = 20,5 г/моль
М(1/z X) восстановителя H2S = 34/2 =17 г/моль
 2020-09-24
2020-09-24 154
154








