Лабораторная работа по теме «Гидроксисоединения»
Опыт 1. Получение этилата натрия и его гидролиз.
В сухую пробирку поместите 3 капли абсолютного (безводного) спирта и маленький кусочек металлического натрия, предварительно отжатый от керосина на фильтровальной бумаге. Наблюдать выделение пузырьков водорода. Белый осадок этилата натрия растворить в 2-4 каплях этанола, добавить 1 каплю 1% спиртового раствора фенолфталеина, 1-2 капли воды. Объясните появление малиновой окраски.
При оформлении опыта написать уравнения реакций:
1) C2H5OH + Na ®
2) гидролиз этилата натрия (слова заменить формулами, уравнением)
3) указать среду при гидролизе и цвет фенолфталеина.
Указать наблюдения (значки газа, осадка, цвет).
Вопросы:
1. Почему спирты реагируют с натрием медленнее, чем вода?
2. Почему вода разлагает этилат натрия?
рКа(С2Н5ОН) = 18,0; рКа(Н2О) = 15,7.
Опыт 2. Получение этиленгликолята меди (II)
К 2 каплям 2% раствора сульфата меди (II) CuSO4 прибавить 2 капли 10% NaOH, получить хлопьевидный осадок гидроксида меди (II) Cu(OH)2. Добавить к нему 2 капли этиленгликоля, встряхнуть пробирку, наблюдать растворение осадка с образованием комплексной соли ярко-синего цвета. Описать наблюдения и схему качественной реакции на диольный фрагмент в виде уравнений реакций:
1) CuSO4 + NaOH ®
2) 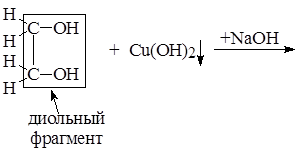
Указать наблюдения.
Опыт 3. Получение фенолята натрия и разложение его кислотой
В пробирку поместить 3 капли воды и несколько кристалликов фенола, встряхнуть. К образовавшейся мутной эмульсии добавить по каплям 10% раствор NaOH до растворения. Подкислить этот раствор несколькими каплями 10% раствора HCl.
Написать уравнения реакций с указанием признаков реакций:
1) 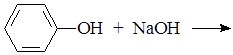
мутный раствор
(плохо растворим в воде)
2) фенолят натрия (написать формулу) + HCl ® формулы продуктов?
Вопросы:
1. Почему фенолят натрия не разлагается водой?
Опыт 4. Цветные реакции на фенолы
В три пробирки поместить по несколько кристалликов: в 1-ую – фенола; 2-ую – резорцина; 3-ю – пирокатехина. Добавить по 5-10 капель воды и 1-2 капли раствора хлорида железа (III). Описать окраску и схему взаимодействия фенола с FeCl3.
Для оформления опыта написать реакции с фенолом, во второй и третьей пробирке указать только цвет продукта:
1) Фенол (формула?) + FeCl3 ® ? +? (написать формулы продуктов)
фенолят железа
темно-фиолетовый
2) Резорцин (формула) + FeCl3® цвет?
3) Пирокатехин (формула) + FeCl3® цвет?
Опыт 5. Окисление этанола хромовой смесью
В пробирку поместить 2 капли этанола, 1 каплю 10% раствора H2SO4 и 2 капли 10% K2Cr2O7. Полученный оранжевый раствор нагреть на спиртовке до начала изменения окраски – появление сине-зеленой окраски сульфата хрома (III) Cr2(SO4)3. Продукт окисления этанола – уксусный альдегид – имеет характерный запах прелых антоновских яблок. Нюхать осторожно!
Уравнение: 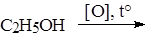
 2020-09-28
2020-09-28 563
563






