Атомно-молекулярная теория. Химический эквивалент.
6. 10,33 г/экв; фосфор
7. 59,5 г/экв, 29,75 г/экв; олово
8. 46,67 г/экв; церий
9. 12 г/экв; магний
10. 12 г/экв; титан
11. 20% СН4, 80% О2
12. 23,17% О2, 75,31% N2; р(О2)=0,21 атм; р(N2)=0,78 атм
13. a) Pобщ = 1 атм
b) р(CО2)=0,2 атм, р(О2)=0,5 атм, р(CH4)=0,3 атм
14. 11,44 мг
15. 1,693 кг CaCO3
16. 5,26% О2, 84,21% N2, 10,53% H2O
17. C3H8O3
18. а) M(смеси)=28,8 г/моль; р(О2)=0,2 атм, р(N2)=0,8 атм
b) M(смеси)=28 г/моль; р(СО2)=0,3 атм, р(N2)=0,5 атм, р(Не)=0,2 атм
Раздел 2. Введение в теорию химического процесса
Термохимия
18. а) 169 кДж
b) -2733 кДж
c) -61 кДж
19. а) -105 кДж/моль
b) -620 кДж/моль
20. а) -1224 кДж/моль
b) 1677 кДж/моль
21. -170 кДж
22. -56 кДж
23. 147 кДж
24. -126 кДж
25. 82 кДж/моль
26. -331 кДж/моль
Химическая термодинамика
10. 564 Дж/моль∙К
12. а) -384341 Дж; -320600 Дж; 4531 K
b) -9041 Дж; -58000 Дж; 393 K
c) 91896 Дж; -106700 Дж; 623 K
d) -34557 Дж; 16900 Дж; 769 K
e) -842687 Дж; -815800 Дж; 10253 K
f) 38609 Дж; -6600 Дж; 898 K
14. 1000∙∆S0 ≈ 200 кДж
15. 30 кДж
16. 27 Дж/моль∙К
Раздел 3. Основы химической кинетики
19. (1)
20. V = k∙[A]2∙[B]
22. 2
23. 51,76 кДж
24. 5,4 кДж
26. V = 0,025∙[A]∙[B]2
Раздел 4. Химическое равновесие
5. 5,64∙10-4; давление уменьшится в 1,05 раза
6. 73,06
7. СО2:Н2 = 9:1
8. [CO2]=0,105 моль/л, [CO]=0,195 моль/л
9. 1,038 моль/л
10. [Cl2]=0,011 моль/л, [COCl2]=0,009 моль/л
11. рисх=2,64 атм, ркон=2,25 атм
12. 0,0167 моль/л
13. 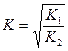
15. 1053 К
16. 1088 К
17. 614 К
18. ∆Н0 = 14,45 кДж/моль; ∆S0 = -6,66 Дж/моль∙K
19. [Ala] = [Gly] = 1,503 моль/л; К = 1,33∙10-3; ∆G0 = 16,38 кДж/моль
20. ∆Н0 > 0; ∆S0 < 0
Раздел 5. Растворы.
Способы выражения концентрации растворов
2. 3902,4 г
3. 71,5 мл
4. 1200 мл; если ρ = 1,02 г/мл то СМ = 0,5 М, Сн = 0,5 н, m = 0,51 моль/кг р-ля
5. V40% = 864 мл, V10% = 1019 мл
6. 9 кг
7. СМ = 1,18 М, Сн = 2,36 н
8. 45 мл
9. 43,7 мл
10. 6,625 г
11. Сн = 7,52 н, 30,25%
12. Сн = 0,46 н
13. 30 мл
14. 0,19 н
15. 0,1867 н
Растворы неэлектролитов
11. 1238,2 кПа
12. 309,55 кПа
13. 10-3 моль
14. 2,04 кПа
15. 24,8 кПа
16. 97,99 кПа
17. 120,84 г/моль
18. 0,250С
19. 4,69
20. 32 г/моль, 11,10 мПа
21. Из 8 атомов
22. -0,560С
23. 40,625
24. 500 г/моль
25. 48%
26. 144 г/моль
Растворы электролитов
2. [K+] = 0,4 моль/л, [SO42-] = 0,2 моль/л
3. [Al+] = 0,04 моль/л, Cн = 0,12 н
4. [Na+] = 1,8 моль/л, [PO43-] = 0,6 моль/л
5. 0,046
6. 0,008 моль/л
7. 3,387∙10-4
8. 2,13∙10-5 моль/л
9. 900 мл
10. [CH3COO-] = 1,8∙10-4 моль/л
11. В 166,7 раза
12. 8,9∙10-5
13. a) 0,039 M
b) 7,08∙10-4 M
PH и гидролиз солей
8. 10
9. 3,38
10. В 1,86 раза
11. 11,4
12. 4,75
13. 12,96
14. 1,16
16. 3,12
17. 0,86
18. a) 10-6 M
b) 2∙10-7 M
c) 4∙10-8 M
25. a) 11,09
b) 3,24
c) 12,95
d) 10,76
e) 11,5
27. В 94,6 раза
28. СМ(HCl) = 2,5∙10-2 M, СМ(KOH) = 4∙10-2 M
29. 825 г
30. 5,69∙10-3 M
31. pH = 7,09
32. 9,33
33. 8,95
34. 1,9
35. 2,9
36. 2,28
37. 9,1
38. 2,5∙10-2 M
39. 3,3∙10-7
Буферные растворы
7. [H+] = 1,125∙10-4 M, [OH-] = 8,9∙10-11 M
8. pH = 8,26
9. 0,166 г
10. 4,19
11. a) 4,66
b) 6,64
c) 10,63
d) 7,2
e) 9,08
12. 11,12 (NH3): 1 (NH4OH)
13. 15,8:1
14. 4,66
15. 19,5:1 (норма), 4,9:1 (лихорадка)
16. 8
17. 0,0244 М
18. 3,86
19. 2,35 г
20. 41,66 ммоль/л
21. 3,15
22. 2,1:1
23. Ka = 2,59∙10-7 M, pKa = 6,6
Произведение растворимости
5. 2,74∙10-9
6. 1,69∙10-4
7. a) 2,14∙10-4 M
b) 4∙10-7 M
c) 3,2∙10-4 M
8. Да (в 1 мл 3,6∙10-4 г осадка)
9. 2,19∙10-10 M
10. Осадок не образуется
11. Да
12. Ag2C2O4 в 4,85 раза
13. Достигается
14. a) 96 л
b) 244 л
c) 453 л
Раздел 6. Окислительно-восстановительные реакции.
10. 43,4 мл
Восстановительные потенциалы
3. Влево
4. Можно всеми, кроме с)
5. Селенистая кислота – окислитель
6. Можно всеми
7. Нельзя
8. Нет
14. Может
16. 1042
20. 0,031 В
21. -0,29 В
22. 0,544 В
24. 2,55
25. 0,173 В
[1] В случае, когда давление измеряется в других единицах, используются следующие значения газовых постоянных: R = 62,36 мм.рт.ст.∙л/К∙моль; R = 0,082 атм∙л/К∙моль
[2] Кроме DH°ат используется стандартная энтальпия диссоциации двухатомных молекул DH°дисс (изменение энтальпии при образовании газообразных атомов из 1 моль простого вещества). DH°дисс =2 DH°ат.
[3] n – количество атомов О или Н, которых не хватает в той или иной части уравнения.
[4] Знак «–» означает добавление соответствующих частиц в противоположную часть полуреакции.
 2020-09-24
2020-09-24 101
101







