Адиабатическими называются процессы, происходящие без теплообмена с окружающей средой.
Адиабатический процесс описывается уравнением Пуассона:
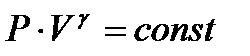 , (2.6)
, (2.6)
где Р – давление; V – объем; γ – показатель адиабаты, который в настоящей работе требуется определить.
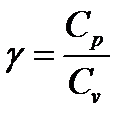 ,
,
где Сp – молярная теплоемкость при постоянном давлении;
Сv – молярная теплоемкость при постоянном объеме.
Молярной теплоемкостью называется величина, равная количеству теплоты, которую надо сообщить 1 молю вещества, чтобы повысить его температуру на 1К. Величина теплоемкости зависит от способа, которым системе сообщается тепло.
Можно показать, что
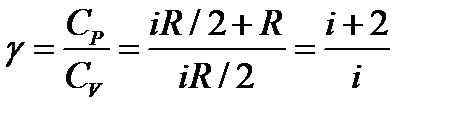 (2.7)
(2.7)
где i – число степеней свободы (число независимых координат, определяющих положение молекулы в пространстве), R – универсальная газовая постоянная, R = 8,31 Дж/(К·моль).
Число степеней свободы i зависит от строения молекулы газа.
Если газ:
– одноатомный: i = 3 (три степени свободы поступательного движения);
– двухатомный: i = 5 (три степени свободы поступательного движения, две степени свободы вращательного движения);
– трехатомный и более: i = 6 (три степени свободы поступательного движения и три степени свободы вращательного движения).
Первое начало термодинамики является выражением закона сохранения и изменения энергии применительно к термодинамике.
Формулируется он так: количество теплоты Q, сообщаемое телу, идет на увеличение его внутренней энергии ∆U и на совершение телом работы А против внешних сил:
Q = ∆U+ А (2.8)
В случае адиабатического процесса Q=0 и первое начало термодинамики принимает вид:
А = – ∆U (2.9)
Знак минус показывает, что при адиабатическом расширении система совершает работу за счет своей внутренней энергии.
Работа 2.2 Определение показателя адиабаты воздуха
Цель работы: использование метода Клемана–Дезорма для экспериментального определения отношения молярных теплоемкостей воздуха при постоянном давлении и постоянном объеме.
Описание установки
Для определения показателя адиабаты воздуха используется установка, представленная на рисунке 2.2. Она состоит из двух блоков. В нижнем блоке находится рабочий металлический сосуд, емкостью 3,5 л, совмещенный с компрессором. Компрессор предназначен для создания добавочного давления в рабочем сосуде, он включается переключателем «Компрессор» (2), установленным на передней панели установки. Кран К1 (3) предотвращает сброс давления из рабочего сосуда после остановки компрессора. Пневмотумблер «Атмосфера» (4) позволяет на короткое время соединять рабочий сосуд с атмосферой. Давление в колбе измеряется дифференциальным датчиком давления (5). В установке также предусмотрен контроль температуры (измеритель температуры 6) как внутри колбы, так и снаружи. Подключение установки осуществляется выключателем 1.

Рисунок 2.2 – Общий вид экспериментальной установки
При накачивании в рабочий сосуд некоторого количества воздуха с помощью компрессора давление и температура воздуха внутри сосуда повысятся. Вследствие теплообмена воздуха с окружающей средой через некоторое время температура воздуха, находящегося в баллоне, сравняется с температурой внешней среды t1. При этом давление, установившееся в сосуде, равно
p1=р0+Δр1,
где р0 – атмосферное давление; Δр1 – добавочное давление.
Состояние воздуха внутри баллона (состояние 1) характеризуется термодинамическими параметрами: p1, V1 и t1.
Если открыть на короткое время пневмотумблер «Атмосфера», то воздух в баллоне будет расширяться. Этот процесс расширения можно считать адиабатическим, т.е. протекающим без теплообмена с окружающей средой. При этом давление газа уменьшается и достигает атмосферного, температура также понижается (расширяясь, газ совершает работу против атмосферного давления за счет уменьшения внутренней энергии) и оказывается ниже комнатной. В конце адиабатического процесса (состояние 2) параметры воздуха будут p0,V2 и t2. Применяя к состояниям 1 и 2 уравнение Пуассона для адиабатического процесса, получим:
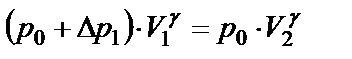 , (2.10)
, (2.10)
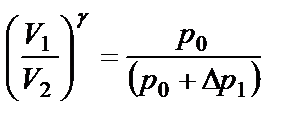 (2.11)
(2.11)
Охладившийся при расширении воздух в сосуде через некоторое время вследствие теплообмена нагреется до температуры внешней среды t1: давление возрастет до некоторой величины:
p2 = р0+Δр2,
где Δр2 – новое добавочное давление.
Поскольку объём воздуха не изменится и останется равным V2, то состояние воздуха (состояние 3) характеризуется параметрами: p2,V2 и t1 . Так как в 1 и 3 состояниях воздух имеет одну и ту же температуру, то p1V1 = p2V2:
(р0+Δр1)· V1=(р0+Δр2) · V2, (2.12)
откуда:
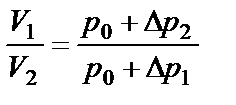 (2.13)
(2.13)
Возведя обе части уравнения (2.12) в степень γ:
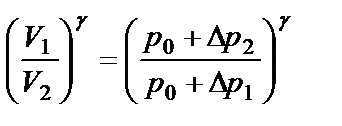 (2.14)
(2.14)
пользуясь выражениями (2.11) и (2.14), получим:
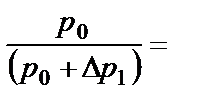
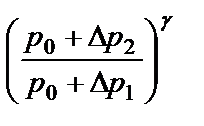 (2.15)
(2.15)
Логарифмируя (2.15) и решая получившееся уравнение относительно γ, находим:
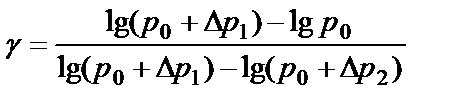 (2.16)
(2.16)
Так как давления р0, р0+р1 и р0+р2 в условиях опыта мало отличаются друг от друга, можно показать, что разности логарифмов приблизительно равны разностям самих давлений:
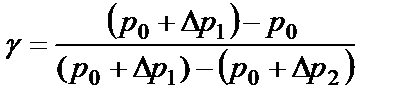 , (2.17)
, (2.17)
или
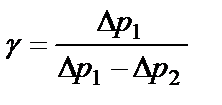 (2.18)
(2.18)
 2020-10-10
2020-10-10 193
193