ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОЁМКОСТИ
ТВЕРДЫХ ТЕЛ
Цель работы: проверка выполнимости закона Дюлонга и Пти для ряда исследуемых твердых тел.
Краткая теория
Согласно классической теории теплоемкости при не слишком низких температурах, молярная теплоемкость химически простых веществ в кристаллическом состоянии одинакова и равна 25 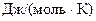 . Это утверждение составляет содержание закона Дюлонга и Пти, установленного опытным путем.
. Это утверждение составляет содержание закона Дюлонга и Пти, установленного опытным путем.
Между частицами, образующими кристаллическую решетку твердых тел, существуют силы взаимодействия. Расположение частиц в узлах кристаллической решетки отвечает минимуму их взаимной потенциальной энергии. При смещении частиц из положения равновесия в любом направлении появляется сила, стремящаяся вернуть частицу в первоначальное положение, вследствие чего возникают её колебания.
При точном рассмотрении задачи необходимо учитывать, что частицы в решетке взаимодействуют друг с другом и их колебания надо рассматривать как связанные. Однако, при достаточно высоких температурах, когда энергия становится большой, колебания частиц можно рассматривать приближенно как независимые друг от друга.
Полная энергия частицы U равна сумме кинетической Ек и потенциальной Еп:
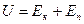 .
.
Колебания частиц в узлах кристаллической решетки приближенно являются гармоническими. При этом как кинетическая, так и потенциальная энергии гармонических колебаний частицы являются периодическими функциями времени и их средние значения 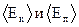 равны друг другу:
равны друг другу: 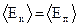 . Поэтому среднее значение полной энергии
. Поэтому среднее значение полной энергии
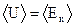 . (1)
. (1)
С другой стороны, из кинетической теории идеального газа известно, что средняя кинетическая энергия одноатомных молекул (изолированных частиц)
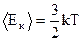 , (2)
, (2)
где k - постоянная Больцмана, Т – абсолютная температура.
Поскольку, как было отмечено, атомы или ионы кристаллической решетки при достаточно высоких температурах колеблются независимо друг от друга, к ним также применима формула (2). Тогда из (1) и (2) имеем
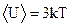 . (3)
. (3)
Полную внутреннюю энергию одного моля твердого тела получим умножением средней энергии одной частицы на число независимо колеблющихся частиц, содержащихся в одном моле, т.е. на постоянную Авогадро NА:
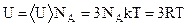 , (4)
, (4)
где R – молярная газовая постоянная.

Для твердых тел вследствие малого коэффициента теплового расширения теплоемкости при постоянном давлении и постоянном объеме практически не различаются. Поэтому общее выражение теплоемкости твердого тела совпадает со значением молярной теплоемкости при V = const:
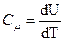 .
.
Из формулы (4) окончательно следует, что

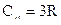 .
.
Подставляя численное значение молярной газовой постоянной, получаем:
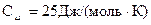 . (5)
. (5)
Это равенство выполняется с довольно хорошим приближением для многих веществ при комнатной температуре. В области низких температур наблюдается отклонение (рис.1).
Вблизи абсолютного нуля молярная теплоемкость всех тел пропорциональна Т3, и только при достаточно высокой, характерной для каждого вещества температуре, начинает выполняться равенство (5).
Строгая теория теплоемкости твердых тел создана А. Эйнштейном и П. Дебаем. Она учитывает, что колебания частиц в кристаллической решетке не являются независимыми и что энергия колебательного движения квантована.
 2020-10-10
2020-10-10 279
279








