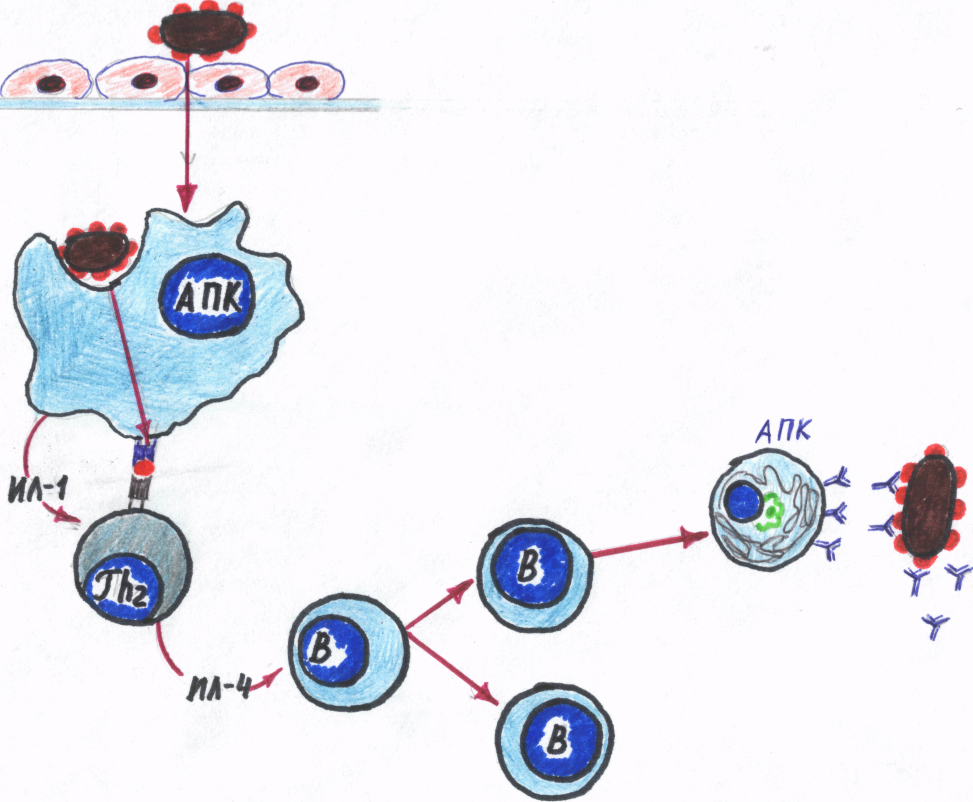
Гуморальный иммунный ответ является следствием кооперации Тх2 (CD4+) и В-лимфоцитов, превращающихся в плазматические клетки, способные продуцировать антитела (Ig) разных классов (рис. 15). Антигенспецифические антитела и являются основным эффекторным фактором гуморального механизма иммунного ответа.
Гуморальный иммунный ответ инициируется захватом АПК антигена. В роли АПК выступают макрофаги и В-лимфоциты. В-лимфоциты сначала функционируют как АПК, а затем, дифференцируясь в плазматические клетки, как антителопродуцирующие.
АПК своим антигенраспознающим рецептором связывает, а затем поглощает антиген, в фагосоме происходит частичное переваривание («процессинг») антигена, освобождающиеся при этом протеины антигена экспрессируются на поверхности АПК в комплексе с антигеном гистосовместимости класса II (подробно об антигенах гистосовместимости – см. в гл. 9). Затем экспрессированный антиген представляется (презентируется) Т-хелперным клеткам – Тх2. Т-клеточный распознающий рецептор (TCR) Тх2 связывает экспрессированные протеины антигена.
| ИЛ-1 |
| АОК |
| Th2 |
| АПК |
| В |
| В |
|
| Аг |
| Аг |
| АОК |
Рис.15. Схема кооперации клеток в гуморальном ответе
адаптивного иммунитета:
| ИЛ-4 |
ИЛ-4 – интерлейкин-4; В – В-клетки; АОК – антителообразующая клетка (плазмоцит)
Помимо В-лимфоцитов, как было отмечено выше, функции АПК могут выполнять и макрофаги. В данном случае их значимость в презентации антигена Тх2 невелика, но они более важны как источник выработки цитокина ИЛ-1. Последний может
| АПК |
| АОК |
| ИЛ-4 |
Следующим этапом в иммунном ответе является превращение накопившегося клона антигенспецифических В-лимфоцитов в антителообразующие клетки – плазматические клетки. Для реализации этого этапа дифференцировки В-лимфоциты превращаются в бластные клетки и мигрируют в краевые зоны белой пульпы селезенки, в лимфатических узлах – в медуллярные шнуры. Значительная часть этих клеток покидает лимфоидные органы и мигрирует в красный костный мозг, где и завершается процесс превращения бластных клеток в плазматические клетки. Плазматические клетки продуцируют и секретируют антитела. При первичном иммунном ответе вначале синтезируются только IgM. Затем происходит переключение синтеза антител с IgM на IgG и далее на IgA и IgE. Концентрация сывороточныхIgM-антител достигает пикового уровня на 5–6-е сут, IgG-антител – на 10–12-е сут. Высокое содержание этих антител сохраняется до 20–25-х сут, а затем титр антител медленно снижается в течение 2–3 мес. Вклад антител других классов в пул сывороточных антител обычно невелик. Даже при аллергических реакциях абсолютное количество реагиновых IgE-антител несопоставимо ниже, чем IgM- иIgG-антител.
Иммуноглобулины
Иммуноглобулины (Ig), выполняющие в организме функцию антител, синтезируются плазматическими клетками, которые являются конечным этапом дифференцировки В-лимфоцита, наступившей в результате антигенного стимула и хелперного сигнала.
Иммуноглобулины представляют собой белки плазмы, которые при электрофорезе мигрируют как гамма-глобулины и образуют диффузную полосу в гамма-области электрофореграммы, что подтверждает их гетерогенность. Иммуноглобулины относятся к полифункциональным белкам и реализуют следующие основные функции: 1) специфически распознают самые разнообразные антигены и гаптены (неполные антигены); 2) взаимодействуют с другими иммунокомпетентными клетками, имеющими к ним соответствующие рецепторы; 3) активируют систему комплемента; 4) облегчают фагоцитоз, выступая в роли опсонинов (опсонизация – «облегчение»). Что касается опсонизирующей функции иммуноглобулинов, она обеспечивается тем, что молекулы иммуноглобулинов «обволакивают» антиген и благодаря этому облегчается процесс поглощения фагоцитом антигена.
В настоящее время известно пять основных классов иммуноглобулинов человека: IgA, IgM, IgG, IgE и IgD.
На рис. 16 представлена структура молекулы иммуноглобулина G. Как видно изрис.16, мономерные единицы каждого из пяти классов иммуноглобулинов состоят из двух идентичных тяжелых (Н) (от англ. Heavy – тяжелый) и двух идентичных легких (L) (от англ. Light – легкий) цепей, которые удерживаются вместе дисульфидными (ковалентными) инековалентными связями. Легкие цепи (L-цепи) представлены двумя типами: лямбда (λ)и каппа (κ), а тяжелые (Н) – пятью: альфа (α), мю (µ), гамма (γ), дельта (δ) и эпсилон (ε). Тяжелые цепи определяют класс иммуноглобулинов – А, М, G, D, и Е.
Рис. 16. Структура молекулы иммуноглобулина G
(по Ройту И., 1991)
Легкие цепи имеют молекулярную массу приблизительно 2,3´104 д и состоят примерно из 200 аминокислотных остатков. Отдельно взятая молекула иммуноглобулина любого класса может содержать идентичные либо каппа-, либо лямбда-цепи, но никогда обе.
Тяжелые цепи имеют молекулярную массу приблизительно вдвое большую (0,005-7´104 д) и состоят примерно из 400 аминокислотных остатков.
Как видно на рис. 16, молекулы иммуноглобулинов состоят из двух видов фрагментов: Fab (fragment antigen binding, англ.) – антигенсвязывающего и Fc (fragment crystalline, англ.) – кристаллизующегося. Если на молекулу IgG воздействовать папаином, она распадется на три фрагмента: два Fab-фрагмента и один Fc-фраг-мент. Область, в которой соединяются Fab- и Fc-фрагменты молекул иммуноглобулинов, называется шарнирной. За счет шарнирной области субъединицы молекул иммуноглобулинов (цепи) обладают способностью к вращению по отношению друг к другу, что обусловливает гибкость молекул иммуноглобулинов.
Между L- и Н-цепями есть определенное сходство, очень важное для всего комплекса иммунологических реакций: обе oни имеют вариабельную и константную область (см. рис. 16). Вариабельная часть Ig состоит из легких и тяжелых цепей, различна для разных Ig, и именно она отвечает за специфичность Ig в отношении определенного антигена. Принадлежность Ig к тому или иному классу не влияет на их специфичность к антигенам, но степень специфичности различна у разных классов Ig: наиболее специфичны IgG, менее IgA и еще меньше IgM.
После соединения с антигеном и образования иммунного комплекса (ИК) молекула Ig сохраняет достаточно выраженную активность за счет второго, неспецифического, участка молекулы – Fc. Fc (константная частьмолекулы Ig) состоит только из тяжелых цепей, не имеет отношения к специфичности, но обусловливает ряд важных биологических свойств Ig, получивших название эффекторных.
Сложная и многогранная роль Ig, их функциональная неоднозначность еще раз заставляют обратить внимание на особенности их синтеза. Как указывалось выше, синтез иммуноглобулинов, осуществляемый В-лимфоцитами, напрямую с действием какого-либо антигена не связан. Так, в организме еще до появления того или иного антигена существуют клоны В-лимфо-цитов, которые способны продуцировать разнообразные по специфичности Ig. Синтез Ig происходит постоянно и в определенной степени не зависит от действия конкретного антигена.
При расщеплении молекул иммуноглобулина пепсином образуются два фрагмента: F(ab)2 и Fc. Двухвалентный F(ab)2-фрагмент вследствие своей двухвалентности действует как полное антитело и обладает способностью преципитировать или агглютинировать специфические антигены.
Специфичность антител обусловлена первичной последовательностью расположения аминокислот в вариабельной области Fab-фрагмента, которая, собственно, и обеспечивает связь с антигеном и поэтому считается активным центром молекулы Ig. Зоны повышенной изменчивости аминокислот в вариабельных областях тяжелых и легких цепей названы гипервариабельными участками(«горячие точки») (см. рис. 6). Считается, что этим обеспечивается разнообразие спектра специфичности антител.
В Fc-фрагменте молекул Ig расположены центры, ответственные за их разнообразные биологические функции: 1) фиксацию на лимфоцитах и фагоцитах; 2) связывание первого компонента системы комплемента; 3) транспорт через плаценту и другие биологические мембраны. Способность Ig связываться с антигенами характеризуется следующими свойствами: авидностью и аффинностью (или аффинитетом).
Прочность связи антитела с соответствующим антигеном называется авидностью. Авидность (жадность) антител в процессе иммунного ответа меняется и зависит от их валентности. В свою очередь, валентность антител зависит от числа их активных центров. Так, например, молекула IgG двухвалентна, a IgM – десятивалентна. Антитела с двумя валентностями более полноценно связывают антиген, в отличие от моновалентных антител (неполных или блокирующих), которые не способны самостоятельно вызвать агглютинацию или преципитацию антигенов.
Точность совпадения (сродства) пространственной конфигурации активного центра иммуноглобулина с конфигурацией антигенной детерминанты обозначается термином «аффинитет», или «аффинность антитела». Ее определяют как сумму межмолекулярных сил притяжения и отталкивания, возникающих при взаимодействии антигенсвязывающего центра антител и антигенной детерминанты. Аффинность антител в процессе иммунизации нарастает и обеспечивает более полную связь с антигеном.
Таким образом, прочность связи антител зависит как от аффинности, так и от валентности, приходящейся в среднем на одну молекулу иммуноглобулинов. Приравной аффинности авидность IgM будет больше, чем IgG, поскольку молекула IgM десятивалентна, a IgG – двухвалентна.
Иммуноглобулин М
Иммуноглобулин имеет молекулярную массу 9,6´105D, составляет 5-10% всех сывороточных иммуноглобулинов (табл.4).
Таблица 4
Основные характеристики иммуноглобулинов
| Ig | Количество в cыворотке крови | Доля к общему количеству Ig, % | Функция | Период полураспада, дн. |
| IgM | 0,4-2,2 г/л | ~ 10 | Вырабатываются у плода. Ранние антитела против вирусов и грамотрицательных бактерий; активируют комплемент, усиливают фагоцитоз | 4-5 |
| IgG IgG1 IgG2 IgG3 IgG4 | 7-18 г/л | ~70 60 30 7 3 | Поздние антитела против полисахаридных антигенов бактерий (G2>G1); активируют комплемент (G3>G2>G1), усиливают фагоцитоз, проникают через плаценту, нейтрализуют токсины | 21 |
| IgA | 0,8-3,7 г/л | 15 | Защищают слизистые оболочки (секреторный IgA), нейтрализуют вирусы и бактериальные токсины | 5-6 |
| IgE | ~0,25 мг/л | < 5 | Индуцируют аллергию, анафилаксию; реализуют защиту от паразитов; активируют тканевые базофилы | 2-3 |
| IgD | 3-170 мг/л | < 1 | Дифференцировка лимфоцитов | 2-3 |
В сыворотке крови содержится 0,4–2,2 г/л Ig М, период его полураспада 4-5 дн. Антитела класса IgM относятся к «ранним», представляют собой основную массу антител, продуцируемых организмом новорожденных при инфицировании и вакцинации, обладают высокой авидностью, активируют комплемент по классическому пути, защищают организм от вирусов и бактерий, не проходят через плаценту. На каждый «новый» для организма антиген образуются антитела класса IgM. К 4-6-му дн. после иммунизации биосинтез антител «переключается» на IgG. Иммуноглобулины М по своей структуре являются наиболее крупномолекулярными – их молекула состоит из пяти мономеров, соединенных специальной связью в единую структурную форму, т.е. имеет десять активных центров (рис. 17).
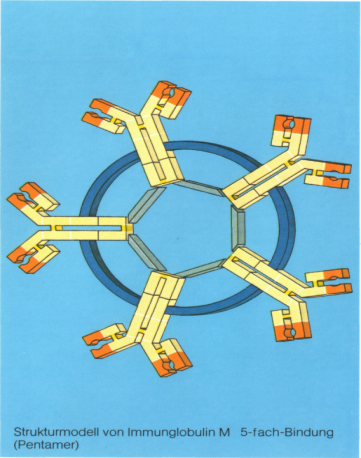 В организме человека IgM определяются еще до встречи с антигеном: именно они формируют пул естественных антител и в мономерной форме являются антигенраспознающими р
В организме человека IgM определяются еще до встречи с антигеном: именно они формируют пул естественных антител и в мономерной форме являются антигенраспознающими р
Вследствие того что IgM не проходит через плаценту, обнаружение в крови новорожденного IgM-антител к инфекционному возбудителю под-
| Рис. 17. Структура IgM |
К IgM относятся холодовые гемагглютинины, антистрептококковые антитела, ревматоидный фактор, изогемагглютинины групп крови – анти-А и анти-В.
Очень важными свойствами IgM являются привлечение ими фагоцитирующих клеток в места расположения антигена или в очаг инфекции и активация фагоцитоза. Опсонизируя антигенный раздражитель, в частности микроорганизмы, и усиливая фагоцитоз, IgM, с одной стороны, снижают антигенную нагрузку, а с другой, опсонизируя возбудитель – антиген, - повышают продуктивность фагоцитоза. По мере увеличения синтеза IgG и нарастания его титра резко тормозится синтез малоспецифичных IgM, который регулируется только уровнем соответствующего ему по специфичности IgG.
Длительный синтез исключительно (или преимущественно) IgM - признак нарушения регуляторной функции Т-лимфо-цитов-хелперов. Гипериммуноглобулинемия М - один из первичных иммунодефицитов, обусловленный отсутствием на Т-лимфоцитах-хелперах CD40 лиганда и в связи с этим – невозможностью передачи костимуляционного сигнала В-лимфо-цитам для переключения синтеза IgM на синтез Ig другого класса.
Об особенностях Т-независимого иммунного ответа уже упоминалось выше. В связи с этим интересен тот факт, что грамотрицательные микробы (например, все возбудители кишечных инфекций) вызывают выработку только IgM без последующего образования клеток иммунологической памяти. Это позволяет понять, почему вакцинация препаратами, полученными из этих микроорганизмов, не дает длительного иммунитета.
Являясь слабоспецифичными, IgM могут связывать сразу пять молекул антигена. Это ведет к образованию крупных иммунных комплексов и способствует более быстрому выведению антигенов из циркуляции, а также предотвращает возможность их прикрепления к клеткам и инициации патологического процесса. Подсчитано, что агглютинирующая и комплементсвязывающая способности IgM в сотни раз активнее, чем у IgG. Часть IgM продуцируется локально и относится к секреторным иммуноглобулинам.
Иммуноглобулин G
Иммуноглобулин G имеет молекулярную массу 1,5´105 д и, в отличие от Ig других классов, способен проникать через плаценту, защищая организм новорожденного от инфекции в первые месяцы жизни. Он составляет до 70% всех сывороточных иммуноглобулинов. Концентрация IgG в сыворотке крови находится в пределах от 7 до 18 г/л. Он является основным антителом вторичного иммунного ответа. Период полураспада IgG самый продолжительный – 21 день. Основная биологическая функция иммуноглобулинов этого класса – защита организма от возбудителей инфекции и продуктов их жизнедеятельности за счет активации комплемента, опсонизации и активации фагоцитоза. Однако не все субклассы IgG человека одинаково связывают комплемент: он легко соединяется с IgG1 и IgG3, слабо - с IgG2 и совсем не связывается с IgG4.
Максимальный синтез IgG наблюдается после повторного введения антигена с соблюдением определенного интервала, иногда до 30-35 дн. Характер процессов, происходящих на каждом этапе формирования иммунитета, влияет на конечный результат иммунизации, т.е. на завершенность иммунного ответа, его полноценность и появление клеток иммунологической памяти. Эти обстоятельства явились обоснованием схем иммунизации – доз антигенов и интервалов их введения. В них учтены характер антигенов и особенности вызываемых ими процессов. Изменения разработанных и обоснованных схем иммунизации, если это не оправдано иммунологически, могут привести к нарушению синтеза Ig и формирования клеток иммунологической памяти, а следовательно, и всего эффекта иммунизации, вплоть до его «извращения» с развитием сенсибилизации.
Уровень IgG в организме регулируется двояко: антигенной стимуляцией, вызывающей его синтез, и разрушением Ig. Конечная концентрация IgG зависит от соотношения процессов его синтеза и деструкции. При недостаточном уровне IgG его разрушение замедляется.
IgG представляют собой наиболее многочисленный класс Ig. Обладая высокой специфичностью, они активно участвуют в иммунном ответе и одновременно регулируют его, влияя на активность других механизмов иммунного ответа – клеточных и гуморальных, определяя в конечном счете полноценность иммунного ответа.
Иммуноглобулин А
Иммуноглобулин А имеет молекулярную массу 1,6´105 д (мономер) и 5,0´105 д (полимер) и составляет до 15% всех сывороточных иммуноглобулинов. IgA существует в двух формах -сывороточной и секреторной.
Концентрация сывороточного IgA составляет 0,8-3,7 г/л, период полураспада 5-6 дн.; он способен обезвреживать микробы и токсины, циркулирующие в крови, однако его действие слабее, чем секреторного IgA. Сывороточный IgA может активировать комплемент по альтернативному пути. Инактивация сывороточного IgA может наступить под влиянием IgA-протеаз, которые продуцируются некоторыми микроорганизмами (например, Neisseria gonorhoeae).
Секреторный IgA отличается наличием дополнительного секреторного компонента (s), синтезирующегося эпителиальными клетками слизистых оболочек и присоединяющегося к молекуле IgA в момент ее прохождения через эпителиальные клетки. S-компонент повышает устойчивость молекулы иммуноглобулина к действию протеолитических ферментов. Секреторный IgA остается на слизистых оболочках, где нейтрализует бактериальные токсины и локализует вирусы, а также стимулирует фагоцитоз, обеспечивая тем самым местную резистентность к инфекции.
Секреторный IgA преобладает в слюне, слезах, секретах желудка и кишок (особенно тонкой кишки), желчи, во влагалищном секрете и в амниотической жидкости, в содержимом легких, бронхов, мочеполовых путей. Богатым источником секреторного IgA является грудное молоко и, особенно, молозиво, где его количество значительно превышает содержание в крови. Благодаря этому обеспечивается достаточно выраженная защита детей первых месяцев жизни при естественном вскармливании. Это обстоятельство трудно переоценить, поскольку IgA начинает синтезироваться лишь с 6 мес. жизни ребенка. Поступление IgA с молозивом и грудным молоком матери предупреждает раннее заселение кишечника ребенка грамотрицательными бактериями, в частности кишечной палочкой, и способствует формированию грамположительной микрофлоры кишок, более благоприятной для новорожденного. Известно, что грамположительные микроорганизмы являются антагонистами возбудителей кишечных инфекций (грамотрицательных бактерий кишечной группы). Это обеспечивает при естественном вскармливании достаточно выраженный иммунитет у детей первых месяцев жизни к возбудителям кишечных инфекций. IgA, связывая микроорганизмы, предотвращает их прикрепление к слизистой оболочке пищеварительного канала.
Таким образом, секреторный IgA, являясь важным элементом местного иммунитета, защищает слизистые оболочки как от поселения на них патогенных микроорганизмов, так и от проникновения последних во внутреннюю среду организма. Тем более важно наличие синергизма между IgA и механизмами неспецифической защиты – комплементом, лизоцимом, фагоцитирующими клетками и их ферментами, что способствует осуществлению антибактериальной защиты, повышая в целом ее эффективность.
Иммуноглобулин Е
Иммуноглобулин Е был обнаружен в 1966 г. у больных атопическими заболеваниями одновременно двумя учеными – К. Ишизака в Америке и Г. Иоханссоном в Швеции. Было установлено, что при реакции гиперчувствительности немедленного типа в организме выявляются специфические антитела (реагины), обладающие способностью сенсибилизировать собственные ткани и не относящиеся ни к одному из известных к тому времени классов иммуноглобулинов. Выделенный ими белок, который имел активность реагинов, был назван IgE. Концентрация IgE в сыворотке крови здоровых людей составляет в среднем 0,25 мг/л, а у больных с атопическими заболеваниями – в десятки и даже сотни раз больше. Период полужизни IgE – 2-3 дн., скорость биосинтеза – 0,02 мг/кг массы тела в сутки. IgE является белком (гамма1-гликопротеидом) с молекулярной массой 1,9 ´105 д.
Способность к образованию IgE в большей степени, чем других Ig, связана с наследственными факторами. Принято считать, что условием развития атопического заболевания является наследственно передающаяся предрасположенность к повышенной продукции IgE. В результате длительных наблюдений за большой популяцией людей установлено, что вероятность заболеть аллергическим заболеванием прямо пропорциональна содержанию IgE в сыворотке крови новорожденного. Содержание IgE в крови меняется с возрастом. У детей до 1 г. оно составляет приблизительно 10% уровня, регистрируемого у здоровых людей среднего возраста. Само по себе повышение уровня IgE не обязательно свидетельствует о наличии аллергического заболевания. Повышенный уровень IgE к наиболее распространенным антигенам обнаружен у 15% вполне здоровых лиц.
Иммуноглобулин Е не связывает комплемент, не проходит через плаценту; быстро и прочно связывается с тканевыми базофилами и с Fc-рецепторами на других «клетках воспаления». В результате взаимодействия фиксированного на поверхности этих клеток IgE со специфическим антигеном происходит их дегрануляция с выделением во внеклеточное пространство биологически активных веществ, обусловливающих клинические проявления аллергического воспаления. Доказано, что IgE-антитела принимают участие в связывании антигенов на слизистой оболочке.
Иммуноглобулин Е продуцируется плазматическими клетками селезенки, миндалин, аденоидов, слизистых оболочек дыхательных путей, желудка и кишок. Продукция IgE начинается у плода очень рано. В отличие от других иммуноглобулинов IgE термолабилен (разрушается при 56 °С). Одна из защитных функций IgE – участие в иммунитете против гельминтов.
Представление о том, что IgE в основном являются причиной многих аллергических заболеваний, не полностью отражает их значение в физиологии и патологии иммунологических процессов. На самом деле IgE, которые действительно участвуют в развитии ряда аллергических реакций, вместе с тем представляют одну из главных линий защиты именно слизистых оболочек, контактирующих с окружающей средой, – верхних и нижних отделов дыхательных путей, кишок.
Инфекционные агенты или чужеродные вещества, прорвавшие «первую линию обороны», которую осуществляют, как правило, IgA, связываются специфическим IgE на поверхности тканевых базофилов. Результатом этого взаимодействия является следующий этап защиты – высвобождение из тканевых базофилов, эозинофилов и базофилов крови вазоактивных аминов и веществ, которые обладают хемотаксической активностью. Это усиливает приток в очаг воспаления других защитных факторов, клеточных и гуморальных: IgG, комплемента, миграцию нейтрофилов, эозинофилов и т.д.
Иммуноглобулин D
Иммуноглобулин D был обнаружен в 1965 г. в виде миеломного белка. Он имеет молекулярную массу 1,8´105 д, концентрация в сыворотке крови в среднем составляет от 3 до 170 мг/л, период полужизни – 3 дн. IgD не связывает комплемент, не проходит через плаценту, не обладает тропностью к тканям. По современным данным, IgD может выполнять роль антигенраспознающего рецептора В-лимфоцитов и играть важную роль в процессе их дифференцировки под влиянием антигенной стимуляции. До настоящего времени биологическая функция этого Ig не изучена.
Кроме описанных выше характеристик, отличающих молекулы Ig одного класса (изотипа) от другого, есть еще два свойства, которые позволяют отличить молекулы Ig внутри класса: это аллотипические и идиотипические различия.
Аллотипические различия Ig обусловлены особенностями строения тех участков его молекул, которыми этот белок одного индивида отличается от Ig такого же класса, но синтезированного другим индивидом такого же вида. Аллотипические маркеры обнаруживаются в тяжелых и легких цепях в их константных областях.
Идиотипические различия Ig определяются антигенной специфичностью какого-либо одного Ig, синтезируемого одним клоном лимфоидных клеток определенного индивида. Идиотипические различия обусловлены индивидуальной последовательностью расположения аминокислот в вариабельных участках легких и тяжелых цепей и, как считается, отражают антигенные свойства активного центра молекулы антитела.
Становление гуморального звена иммунной системы
Становление гуморального иммунного ответа ребенка происходит в процессе встречи иммунной системы с антигенами. У новорожденного такой же уровень IgG, как у матери (в среднем 12 г/л) и начинается выработка собственных IgМ, концентрация которых достигает к 1 г. жизни уровня взрослых. С 3 мес. жизни у ребенка начинается выработка IgG, к 6 г. достигающих уровня взрослых. С 6 мес. начинается синтез IgА, их концентрация достигает уровня взрослых лишь к 12 г. В табл. 5 представлены референсные значения содержания иммуноглобулинов в сыворотке крови детей разного возраста.
Таблица 5
Становление адаптивного иммунного ответа
в процессе борьбы с инфекционными антигенами, г/л
| Возраст | IgM | IgG | IgA |
| Новорожденный | Следы | 12 г/л | 0 |
| 3 – 4 мес. | 0,5 – 0,6 | Менее 1,5 | 0 |
| 6 мес. | 0,7 – 0,9 | 2 – 4 | Следы |
| 12 мес. | 1,2 – 1,8 | 3 – 4 | Следы |
| 5 – 6 лет | 1,2 – 1,8 | 12 | 0,4 – 0,6 |
| 12 лет | 1,2 – 1,8 | 12 | 2,3 |
Клеточный механизм адаптивного иммунитета
Клеточный иммунный ответ разделяется на противовирусный, в котором цитотоксические Т-лимфоциты («Т-киллеры», CD8+-клетки) выступают как в роли регуляторов, так и эффекторов, и хроническое воспаление (ГЧЗТ), в котором в роли регуляторов выступают Tх1 (CD4+-клетки), а в роли эффекторов – активированные ИФН-γ макрофаги.
Противовирусный иммунный ответ
В противовирусном иммунном ответе основными АПК являются дендритные клетки, что связано с их высокой способностью к микропиноцитозу и постоянной «готовностью» к инфицированию вирусами. АПК поглощают вирусные частицы, частично переваривают их. Частичное переваривание обозначают термином «процессинг». В результате процессирования белков вирусного капсида формируются пептидные фрагменты длиной 6–8–10 аминокислот, которые выставляются на мембране клетки в комплексе с молекулами гистосовместимости класса I и презентируются CD8+-лимфоцитам (рис. 18). Т-клеточный рецептор (TCR) распознает вирусный пептид, молекулы CD8 – антигены MHC-I.
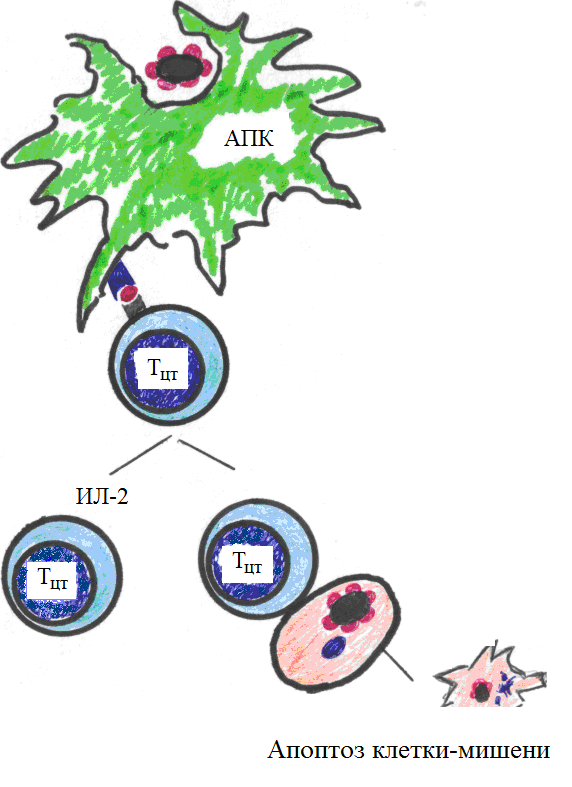
Рис. 18. Схема кооперации клеток в противовирусном иммунном ответе
| Тцт |
| Тцт |
| ИЛ-2 |
| АПК |
Термин «апоптоз» появился в литературе в 1972 г. для обозначения особого типа гибели клеток, отличного от некроза. Установлено, что в клетках организма существует генетическая программа, которая обеспечивает определенный по времени жизненный цикл и при определенных физиологических или патологических условиях включает программу гибели клетки. Апоптоз является тем механизмом, посредством которого осуществляется генетическая программа клеточной гибели. Морфологически апоптоз характеризуется конденсацией хроматина, фрагментацией ДНК и изменением мембраны клетки. В конце концов клетка фрагментируется и подвергается фагоцитированию без развития воспаления.
Итак, после специфического распознавания CD8+-Т-клеткой за счет своего антигенраспознающего рецептора чужеродного пептида, который находится на мембране клетки-мишени в составе молекулы гистосовместимости класса I, в CD8+-клетке (Т-киллере) образуется специальный белок перфорин,способный формировать поры в мембране клетки-мишени. Кроме того, в CD8+-клетке образуется целое семейство сериновых протеаз, собранных в гранулы и названных гранзимами;наиболее важную роль среди них играет гранзим В. На этапе летального удара («поцелуя смерти») при взаимодействии Т-киллера и клетки-мишени перфорин повреждает («пунктирует») мембрану клетки-мишени, и растворимые гранзимы попадают внутрь клетки. Здесь они активируют целую серию цистеиновых протеаз – каспаз (сегодня их известно 10). В результате включается механизм апоптоза, который заканчивается активацией эндонуклеаз и фрагментацией ядра. Апоптотический эффект Т-киллеров усиливается действием продуцируемых Т-киллерами цитокинов – ИФН-γ и ФНОα, которые способны напрямую активировать каспазы. В результате апоптоза погибают клетки-мишени, имеющие антигенные свойства. Это могут быть клетки, содержащие вирус (вирустрансформированные клетки), клетки трансплантатов, опухолевые клетки, собственные клетки при аутоиммунной патологии.
Подобный механизм гибели клетки развивается также под влиянием ЕК-клеток.
ГЧЗТ
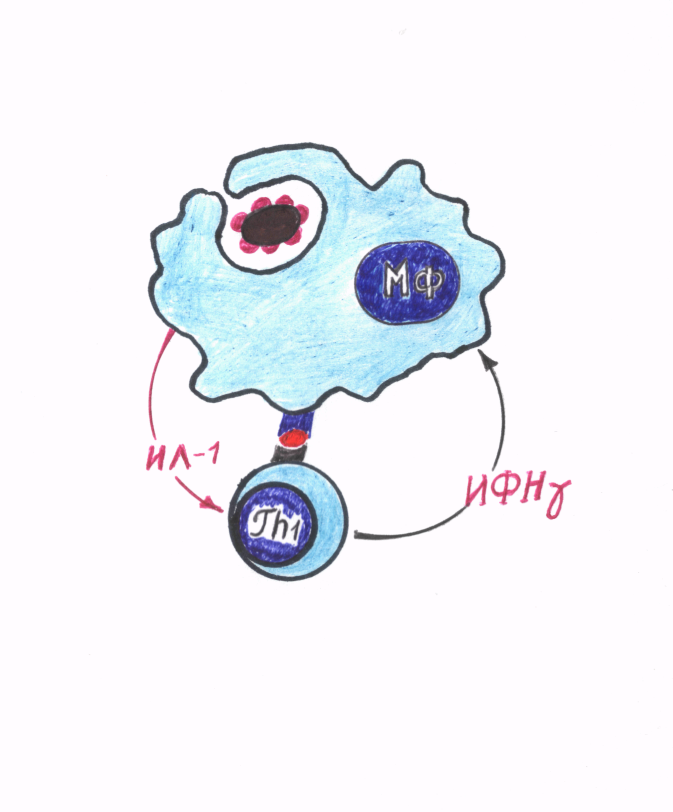
Существует другой механизм презентации антигенов, осуществляемый через антигены гистосовместимости класса II (MHC-II). При этом антиген фагоцитируется АПК, фагосома сливается с лизосомой. Под действием лизосомальных ферментов происходит разрушение антигена и его молекулы длиной 20–30 аминокислот загружаются на молекулы MHC-II, после чего комплекс MHC-II+пептид выставляется на мембрану АПК. В этом случае помимо взаимодействия TCR с комплексом MHC-II+пептид необходимо наличие молекулы CD4 Тх1, опознающей саму молекулу МНС-II (рис. 19).
| Мф |
| ИЛ-1 |
|
| ИФН-g |
| Тх1 |
| Рис. 19. Схема реакции ГЧЗТ |
По механизму ГЧЗТ разрушаются внутриклеточно развивающиеся бактерии – микобактерии туберкулеза, криптококки, бруцеллы и др.
| Th1 |
При активации «наивной» CD4+Tх0 клетки происходит важное событие – это выбор дифференцировки Tх0 в сторону Tх1 или Tх2. Эта дихотомия Т-хелперов играет важнейшую роль в формировании пути иммунного ответа, ибо превращение Tх0 в Tх1 приведет к реакции хронического воспаления, а в Tх2 – к гуморальному иммунному ответу. Выбор пути специализации Tх0 зависит от медиаторного фона, складывающегося в участке презентации. Если презентация происходит в присутствии ИЛ-12, ИЛ-18, ИЛ-21 и/или ИФН-γ, то Tх0 превращается в Tх1, который, в свою очередь, продуцирует ИФН-γ, ИЛ-2, ФНОα, ФНОβ, а также ИЛ-3, GM-CSF и другие цитокины. При этом источником ИЛ-12, ИЛ-18, ИЛ-21 выступают АПК, а ИФН-γ продуцируется NK-клетками. В случае презентации антигена через молекулы MHC-II в присутствии ИЛ-4 клетки Tх0 переходят в Tх2, которые секретируют ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, а также ИЛ-3 и GM-CSF. Источниками ИЛ-4 могут быть тучные клетки, кровяные пластинки, активированные ранее Tх2. Участие тучных клеток в этом процессе не случайно, т.к. проникновение антигена во внутреннюю среду организма, где лежат эти клетки, всегда сопровождается их дегрануляцией и секрецией цитокинов. Продуцируемые Tх2 цитокины (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10) обеспечивают активацию В-лимфоцитов и их трансформацию в плазмоциты, секретирующие антитела. Последние связываются с антигенами, обеспечивая их лизис и фагоцитоз благодаря опсонизирующему действию.
Клетки памяти
Одним из важнейших результатов любого иммунного ответа является формирование клеток памяти. Они составляют лишь небольшую часть клеток из формирующихся клеточных клонов, однако, в отличие от большинства Т- и В-лимфоцитов, участвующих в ответе на антиген, срок их жизни составляет многие месяцы и годы, в то время как активированные Т-лимфоциты и плазматические клетки выживают не более 2 нед. После разных форм иммунного ответа могут формироваться CD8+, CD4+Tх1, CD4+Tх2 и В-клетки памяти, при этом Tх1 клетки не могут переходить в Tх2, и наоборот. Отличительной чертой клеток памяти является их предактивированное состояние, поэтому для их активации не требуется контакта с коактивационной молекулой CD80. Это существенно сокращает сроки формирования вторичного иммунного ответа, отличающегося от первичного более высокой скоростью развития и более высокой амплитудой.
 2020-10-10
2020-10-10 543
543








