К III группе относятся бор, алюминий, галлий, индий, таллий (главная подгруппа), а также скандий, иттрий, лантан и лантаноиды, актиний и актиноиды (побочная подгруппа).
На внешнем электронном уровне элементов главной подгруппы имеется по три электрона (s2p1). Они легко отдают эти электроны или образуют три неспаренных электрона за счет перехода одного s-электрона на р-уровень. Для бора и алюминия характерны соединения только со степенью окисления +3. У элементов подгруппы галлия (галий, индий, таллий) на внешнем электронном уровне также находятся по три электрона, образуя конфигурацию s2p1, но они расположены после 18-электронного слоя. Поэтому в отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Ga, In, TI ослабевают, а металлические свойства усиливаются.
У элементов подгруппы скандия на внешнем электронном уровне также находится по три электрона. Однако эти элементы относятся к переходным d-элементам, электронная конфигурация их валентного слоя d1s2. Эти электроны все три элемента довольно легко отдают.
Элементы подгруппы лантаноидов имеют отличительную конфигурацию внешнего электронного уровня, у них застраивается 4f-уровень и исчезает d-уровень. Начиная с церия все элементы, кроме гадолиния и лютеция, имеют электронную конфигурацию внешнего электронного уровня 4fn6s2 (гадолиний и лютеций имеют 5d1-электроны) Число n изменяется от 2 до 14. Поэтому в образовании валентных связей принимают участие s- и f-электроны. Чаще всего степень окисления лантаноидов +3 реже +4.
Электронное строение валентного слоя актиноидов во многом напоминает электронное строение валентного слоя лантаноидов Все лантанойды и актинойды — типичные металлы.
Все элементы III группы обладают очень сильным сродством к кислороду, и образование их оксидов сопровождается выделением большого количества теплоты. Элементы III группы находят самое разнообразное применение.
Бор был открыт Ж. Гей-Люссаком и Л Тенаром в 1808 г. Содержание его в земной коре составляет 1,2∙10-3%.
Соединения бора с металлами (бориды) обладают высокой твердостью и термостойкостью. Поэтому их используют для получения сверхтвердых и жаропрочных специальных сплавов. Большой термостойкостью обладают карбид и нитрид бора. Последний применяют в качестве высокотемпературной смазки. Кристаллогидрат тетрабората натрия Na2B4O7∙10Н2О (бура) имеет постоянный состав, его растворы применяют в аналитической химии для установления концентрации растворов кислот. Реакция буры с кислотой протекает по уравнению:
Na2B4O7 + 2 HCl + 5 Н2О = 2 NaCl + 4 Н3ВО3.
Содержание галлия в земной коре составляет 1,9∙10-3%. Он был предсказан Д. И. Менделеевым (экаалюминий) и открыт французским химиком Р. Э. Лекок де Буабодраном в 1875 г. Свойства галлия почти полностью совпали со свойствами экаалюминия, предсказанными Д. И. Менделеевым на основе периодического закона Соединения галлия с элементами VI группы (серой, селеном, теллуром) являются полупроводниками. Жидким галлием наполняют высокотемпературные термометры.
Индий был открыт Т. Рихтером и Ф. Райхом в 1863 г. Содержание ею в земной коре составляет 2,5∙10-6%. Добавка индия к сплавам меди увеличивает устойчивость последних к действию морской воды. Присадка этого металла к серебру увеличивает блеск серебра и препятствует его тускнению на воздухе. Индиевые покрытия предохраняют металлы от коррозии. Он входит в состав некоторых сплавов, применяющихся в стоматологии, а также некоторых легкоплавких сплавов (сплав индия, висмута, свинца, олова и кадмия плавится при 47 °С). Соединения индия с различными неметаллами обладают полупроводниковыми свойствами.
Таллий был открыт У. Круксом в 1861 г. Содержание его в земной коре составляет 10-4% Сплав таллия (10%) с оловом (20%) и свинцом (70%) обладает очень высокой кислотоупорностью, он выдерживает действие смеси серной, соляной и азотной кислот. Таллий повышает чувствительность фотоэлементов к инфракрасному излучению, исходящему от нагретых предметов. Соединения таллия весьма ядовиты и вызывают выпадение волос.
Галлий, индий и таллий относятся к рассеянным элементам Содержание их в рудах, как правило, не превышает тысячных долей процента.
Соединения скандия, иттрия, лантана и лантаноидов были известны еще в начале XIX в. Чистый скандий был выделен Л. Ф. Нильсоном в 1879 г. Содержание этого элемента в земной коре составляет 10-3%. Иттрий был открыт Ю Гадолином в 1794 г. Его содержание в земной коре составляет 2,9∙10-3%. Содержание в земной коре лантана, открытого К. Г. Мосандером в 1839 г., составляет 4,9∙10-3%. Применяются эти металлы в основном для получения специальных сплавов, обладающих специфическими электрическими и магнитными свойствами. Кроме того, лантаноиды используются для приготовления различных пирофорных составов, церий — для получения алюминиевых сплавов. Добавка церия увеличивает электропроводность алюминия и улучшает его механические свойства, облегчает прокатку вольфрама. Диоксид церия применяется при шлифовке оптического стекла.
К семейству актиноидов относятся наиболее тяжелые элементы, следующие в периодической системе за актинием.
Из актиноидов практическое применение находят уран, торий и плутоний.
Уран был открыт М. Г. Клапротом в 1789. Содержание его в земной коре составляет 2,5∙10-4%. В природе уран встречается в виде трех изотопов: 23892U — 99,285%, 23592U — 0,71%, 23492U — 0,005%.
Изотоп 23592U способен самопроизвольно распадаться. Поэтому уран, используемый в реакторах в качестве ядерного горючего, обогащают с целью увеличения в нем содержания изотопа 23592U. Для этого изотопа существует понятие критической массы, при достижении которой начинается цепная реакция и происходит ядерный взрыв. Если масса 23592U меньше критической, скорость реакции самопроизвольного распада можно регулировать. Это свойство 23592U используется в ядерном реакторе. Соединения урана применяются также в качестве красителей в полиграфической и силикатной промышленности.
Диоксид тория был открыт Й. Я. Берцелиусом в 1828 г., но металлический торий получен сравнительно недавно. Содержание тория в земной коре составляет 1,3∙10-3%. Небольшие добавки итого металла к вольфраму увеличивают срок службы электроспиралей в лампах накаливания (торий поглощает газы, способствующие быстрому износу вольфрамовой нити). Диоксид тория применяется в медицине, а также при изготовлении некоторых катализаторов.
Плутоний был открыт Г. Сиборгом, Э. Макмилланом, Дж. Кеннеди и А. Валем в 1940 г. Содержание его в земной коре ничтожно. Получают плутоний из продуктов распада горючего ядерных реакторов. Используется он для тех же целей, что и уран-235.
Алюминий
Алюминий — элемент IIIА-группы второго периода периодической системы. Электронная конфигурация атома ns2p1; алюминий относится к блоку p-элементов. Алюминий имеет в соединениях постоянную степень окисления (+3). Алюминий — серебристо-белый металл, легкий и прочный. Температура плавления 660 °С, температура кипения 2500 °С, плотность 2,7 г/см3.
Алюминий впервые получен химическим путем датским химиком Х. К. Эрстедом в 1825 г. В 1854 г французский химик А. Э. Сент-Клер Девиль выделил его электрохимическим методом.
Нахождение в природе. Алюминий является самым распространенным в природе металлом. Содержание его в земной коре составляет 8,05%. Важнейшие природные соединения алюминия — алюмосиликаты, боксит, корунд.
Алюмосиликаты составляют основную массу земной коры. Продукт их выветривания — глина и полевые шпаты (ортоклаз, альбит, анортит). Основу глин составляет каолин Al2O3∙2SiO2∙2Н2О.
Боксит — горная порода, из которой получают алюминий. Состоит главным образом из гидратов оксида алюминия Al2O3∙nН2О.
Физические свойства. Алюминий — серебристо-белый легкий металл, плавящийся при 660 °С. Очень пластичный, легко вытягивается в проволоку и раскатывается в листы из него можно изготовить фольгу толщиной менее 0,01 мм. Алюминий обладает очень большой тепло- и электропроводностью.
Химические свойства. Алюминий — очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей металл от контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу — гидроксид алюминия:
4 Al + 3 О2 + 6 Н2О = 4 Al(ОН)3¯.
Эта реакция сопровождается выделением теплоты.
Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
2 Al + 6 H2O = 2 Al(OН)3 + 3 Н2.
Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:
2 Al + 6 HCl = 2 AlCl3 + 3 Н2,
2 Al + 3 H2SO4 = Аl2(SO4)3 + 3 Н2.
Разбавленная азотная кислота на холоду пассивирует алюминий, но при нагревании алюминий растворяется в ней с выделением монооксида азота, гемиоксида азота свободного азота или аммиака, например:
8 Al + 30 НNО3 = 8 Al(NO3)3 + 3 N2О + 15 Н2О.
Концентрированная азотная кислота пассивирует алюминий.
Так как оксид и гидроксид алюминия обладают амфотерными свойствами, алюминий легко растворяется в водных растворах всех щелочей, кроме гидроксида аммония:
2 Al + 2 КОН + 6 Н2О = 2 K[Al(ОН)4] + 3 Н2.
Порошкообразный алюминий легко взаимодействует со всеми неметаллами. Для начала реакций необходимо нагревание, затем они протекают очень интенсивно и сопровождаются выделением большого количества теплоты:
2 Al + 3 Вr2 = 2 АlВr3 (бромид алюминия),
4 Al + 3 О2 = 2 Аl2О3 (оксид алюминия),
2 Al + 3 S = Al2S3 (сульфид алюминия),
2 Al + N2 = 2 AlN (нитрид алюминия),
4 Al + 3 С = Al4C3 (карбид алюминия).
Сульфид алюминия может существовать только в твердом виде. В водных растворах он подвергается полному гидролизу с образованием гидроксида алюминия и сероводорода:
Аl2S3 + 6 Н2О = 2 Al(ОН)3 + 3 Н2S.
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества теплоты:
8 Al + 3 Fe3O4 = 9 Fe + 4 Аl2O3.
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал молибден, вольфрам и др.), а также для сваривания рельсов. Если с помощью специального запала поджечь смесь мелкого порошка алюминия и магнитного железняка Fe3O4 (термит), то реакция протекает самопроизвольно с разогреванием смеси до 3500 °С. Железо при такой температуре находится в расплавленном состоянии.
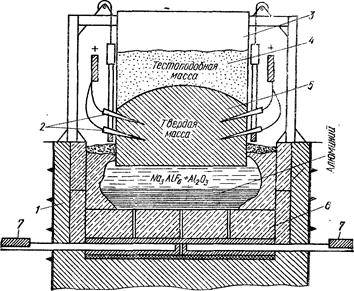
Рис. 9.1. Электролитическая ванна для получения алюминия: 1— огнеупорная футеровка; 2 — токоподводы: 3 — алюминиевый кожух; 4 — электродная масса; 5 — ввод; 6 — графитовый катод; 7 — токоподводящие шины.
Получение. Впервые алюминий был получен восстановлением из хлорида алюминия металлическим натрием:
АlСl3 + 3 Na = 3 NaCl + Al.
В настоящее время его получают электролизом расплавленных солей в электролитических ваннах (рис. 9.1). В качестве электролита служит расплав, содержащий 85-90% криолита — комплексной соли 3NaF∙AlF3 (или Na3AlF6) и 10-15% глинозема — оксида алюминия Аl2О3. Такая смесь плавится при температуре около 1000 °С.
При растворении в расплавленном криолите глинозем ведет себя как соль алюминия и алюминиевой кислоты и диссоциирует на катионы алюминия и анионы кислотного остатка алюминиевой кислоты:
AlAlO3  Al3+ + АlO33-
Al3+ + АlO33-
Криолит также диссоциирует:
Na3AlF6  3 Na+ + AlF63-
3 Na+ + AlF63-
При пропускании электрического тока на аноде в первую очередь разряжается анион АlO33-:
4 AlO33- - 12 е- = 2 Al2О3 + 3 O2
а на катоде выделяется алюминий: Al3+ + 3e- = Al0, полное уравнение процесса:
2 Al2O3  4 Al + 3 O2.
4 Al + 3 O2.
Расход глинозема все время восполняется. Количество криолита практически не меняется, лишь незначительные его потери происходят вследствие образования на аноде тетрафторида углерода CF4.
Электролитическое производство алюминия требует больших затрат электроэнергии (на получение 1 т алюминия расходуется около 20 000 кВт∙ч электроэнергии), поэтому алюминиевые заводы строят вблизи электростанций.
Применение. Из алюминия изготовляют фольгу, применяемую в радиотехнике и для упаковки пищевых продуктов. Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000 °С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида алюминия (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание до 1000 °С, не подвергаясь коррозии. Сплавы алюминия, отличающиеся большой легкостью и прочностью, применяются в производстве теплообменных аппаратов, в самолето- и машиностроении.
Оксид алюминия Аl2O3. Белое вещество с температурой плавления 2050 °С. В природе оксид алюминия встречается в виде корунда и глинозема. Прозрачные кристаллы корунда красивой формы и окраски, окрашенные соединениями хрома в красный цвет, называют рубинами, а окрашенный соединениями титана и железа в синий цвет — сапфирами. Рубины и сапфиры являются драгоценными камнями. В настоящее время их получают искусственно.
Оксид алюминия обладает амфотерными свойствами, но он не растворяется в воде, кислотах и щелочах. При кипячении в концентрированном растворе щелочи он лишь частично переходит в раствор. Оксид алюминия переводят в растворимое состояние сплавлением со щелочами или пиросульфитом калия:
Al2O3 + 2 КОН = 2 КАlO2 + H2O,
Al2O3 + 3 K2S2O7 = 3 К2SO4 + Al2(SO4)3.
Полученные сплавы растворяются в воде (выщелачивают).
Алюминаты образуются при сплавлении оксида алюминия с оксидами, гидроксидами и карбонатами металлов IA- и IIА-групп, например:
Аl2O3 + CaO  Ca(АlO2)2,
Ca(АlO2)2,
Al2O3 + 2 NaOH  2 NaAlO2 + H2O,
2 NaAlO2 + H2O,
Al2O3 + K2CO3  2 КАlO2 + СO2.
2 КАlO2 + СO2.
Природный корунд — очень твердое вещество. Он применяется для изготовления наждачных кругов и шлифовальных порошков. Рубин используют для изготовления втулок часовых и других точных механизмов.
Глинозем используется как сырье для получения алюминия. Обезвоженный оксид алюминия служит адсорбентом при очистке и разделении органических веществ методом хроматографии.
Гидроксид алюминия Al(ОН)3 ¾ белое вещество, при нагревании теряющее воду, превращающееся в оксид алюминия. Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
2 Al(ОН)3 + 3 H2SO4 = Al2(SO4)3 + 6 Н2О,
Al(OH)3 + КОН = К[Al(ОН)4].
Гидроксид алюминия является слабым основанием и еще более слабой кислотой, поэтому соли алюминия находятся в растворе только в присутствии избытка кислоты, а алюминаты — только в присутствии избытка щелочи. При разбавлении растворов водой эти соединения сильно гидролизуют.
Высушенный гидроксид алюминия, потерявший часть воды, не растворяется ни в кислотах, ни в щелочах и этим напоминает оксид алюминия.
Гидроксид алюминия при нагревании разлагается, образуя сначала метагидроксид, а затем — оксид:
Al(ОН)3 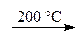 AlO(ОН) + Н2О,
AlO(ОН) + Н2О,
2 АlO(ОН) 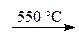 Аl2O3 + Н2O.
Аl2O3 + Н2O.
Растворимые соли алюминия гидролизуются по катиону (кислая реакция среды). Сульфид алюминия гидролизуется полностью, карбонат и сульфит не существуют.
Гидроксид алюминия обладает свойством поглощать различные вещества, поэтому его применяют при очистке воды.
 2020-10-11
2020-10-11 7176
7176