Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков мили кулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются
ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез - это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис., где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов-противоионы в этом слое подвижны, распределяются не равномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения.
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 6.11).
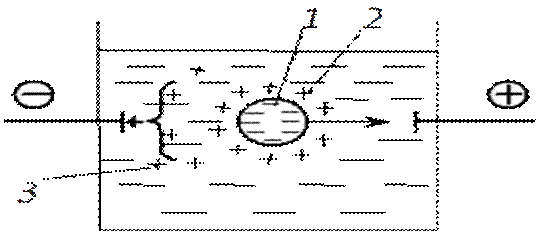
Рис.. Схема электрофореза:
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху - электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 6.12). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду. Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.
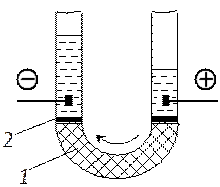
Рис. Схема электроосмоса
1 - дисперсная система; 2 - перегородка
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос может наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем.
ПОНЯТИЕ О РАСТВОРАХ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ (ВМС). БИОПОЛИМЕРЫ.
Высокомолекулярные соединения (ВМС) – это вещества с большой молекулярной массой порядка 50000. Макромолекулы построены из большого числа повторяющихся звеньев. ВМС (или полимеры) получаются в результате полимеризации или поликонденсации.
Все полимеры делятся на:
природные (белки, нуклеиновые кислоты и др.),
синтетические (нейлон, полиэтилен и др.) и
искусственные, которые получаются в результате химической обработки природных полимеров (например, целлофан, нитроклетчатка и др.)
Синтетические полимеры находят широкое применение в медицине (аппарат «искусственная почка», плазма крови, эндопротезирование и много др.). Биополимеры являются структурной основой всех живых организмов. К ним относятся, прежде всего нуклеиновые кислоты, белки и их производные: нуклепротеиды, гликопротеиды, липопротеиды и т.д., а также гликоген. Эти соединения являются основным строительным материалом для протоплазмы и ядерного вещества клеток и содержатся во многих биологических жидкостях. Нуклеиновые кислоты являются полимерами, содержащими от десятков до сотен тысяч нуклеотидов. Они являются важнейшим классом биополимеров, выполняя генетические функции и определяя весь ход развития живого организма.
Полисахариды (крахмал, гликоген и др.) являются полимерами глюкозы. Они выполняют структурную функцию и являются запасной формой питательных веществ. Белки являются природными полимерами, которые образуются в результате реакции поликонденсации аминокислот. Значение белков, нуклеиновых кислот, полисахаридов и их производных чрезвычайно велико, оно подробно рассматривается в курсе биохимии. 2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ ВМС. ИСТИННЫХ И КОЛЛОИДНЫХ РАСТВОРОВ.
Высокомолекулярные соединения образуют растворы, обладающие свойствами как коллоидных,так и истинных растворов. Свойства растворов ВМС, характерные для коллоидных растворов: • размер частиц (молекул ВМС) соответствует размеру коллоидных частиц (10–7 – 10–9 м); • растворы ВМС не проходят через полупроницаемые мембраны;
• явление светорассеивания (размытый конус Тиндаля); • способность к коагуляции;
• медленно диффундируют. Свойства растворов ВМС, характерные для истинных растворов:
• гомогенность;
• термодинамическая устойчивость;
• самопроизвольность образования (растворяются в определенных жидкостях, не требуя стабилизаторов);
• обратимость коагуляции. ВМС имеют и специфические свойства – они набухают, их растворы обладают высокой вязкостью и способностью желатинироваться.
По современной классификации растворы ВМС относят к гомогенным растворам, имеющим ряд свойств коллоидов и специфические свойства.
КРАТКАЯ СТРУКТУРА БЕЛКА. Белки бывают простые и сложные. Простой белок – продукт поликонденсации 20 α-аминокислот. Сложные белки состоят из простого белка и небелковых компонентов. Различают 4 структуры белка. Первичная структура белка – это последовательность аминокислот в полипептидной цепи, связанных ковалентной пептидной связью. Структура полипептидной цепи. Вторичная структура белка является пространственной структурой, образуется за счет ближнего взаимодействия водородных и дисульфидных связей. Это приводит к образованию α-спиралей и β-структур. Третичная структура белка образуется за счет дальнего взаимодействия между макромолекулами. Это межмолекулярные, гидрофобные взаимодействия, а также водородные связи. Каждый белок имеет свою специфическую структуру, называемую конформацией. Четвертичная структура белка образуется из двух и более полипептидных цепей (например, гемоглобин). Объединение таких субъединиц происходит за счет водородных, дисульфидных, гидрофобных связей, сил Ван-дер-Ваальса. Все белки подразделяются на глобулярные и фириллярные..
БЕЛКИ КАК ВЫСОКОМОЛЕКУЛЯРНЫЕ ЭЛЕКТРОЛИТЫ. ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА БЕЛКА И МЕТОДЫ ЕЁ ОПРЕДЕЛЕНИЯ. Молекула белка имеет электрический заряд, обусловленный диссоциацией ионогенных групп (– СООН) и (– NH2): эти группы принадлежат концевым аминокислотам, а также дикарбоновым и диаминовым аминокислотам, расположенным в середине полипептидной цепи. В результате диссоциации образуется биполярный ион (амфи-ион), имеющий положительный и отрицательный заряд. Схематически диссоциацию можно представить так: COOH R NH2 + H2O =R COO- R NH3+
Преобладание в молекуле белка групп – СООН сообщает ему отрицательный заряд, белок проявляет свойства слабой кислоты. Преобладание групп – NH2 сообщает белку положительный заряд и основные свойства.
В зависимости от реакции среды молекула белка заряжается следующим образом:.а) в кислой среде – положительно: H++ COOН- R -NH3+
б) в щелочной среде – отрицательно: COO- -R -NH2
Таким образом, заряд белка зависит от реакции среды, соотношения количества карбоксильных групп и степени их диссоциации. Биполярный ион или амфион принято называть цвиттер-ионом. Значение рН, при котором белок находится в изоэлектрическом состоянии, т.е. в состоянии, при котором число положительных и отрицательных зарядов одинаково, общий заряд равен нулю, называется изоэлектрической точкой белка (ИЭТ). Изоэлектрическая точка является важной характеристикой белков. Каждый белок имеет свою индивидуальную ИЭТ. Существуют следующие методы ее определения:
1. По электрофоретической подвижности. При проведении электрофореза белок при значении рН, равному ИЭТ, не перемещается в электрическом поле.
2. По степени коагуляции (высаливания). В ИЭТ наблюдается наибольшее помутнение раствора и белок выпадает в осадок.
3. По скорости желатинирования. Желатинирование (или застудневание) происходит быстрее всего в ИЭТ.
4. По величине набухания. Наименьшее набухание белка происходит в пробирке, где рН ближе к ИЭТ.
УСТОЙЧИВОСТЬ РАСТВОРОВ ВМС. МЕТОДЫ ОСАЖДЕНИЯ БИОПОЛИМЕРОВ: ВЫСАЛИВАНИЕ,КОАЦЕРВАЦИЯ. ИХБИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ.
Основным фактором термодинамической устойчивости растворов биополимеров (ВМС) является их высокая гидрофильность, которая обусловлена наличием таких гидрофильных групп, как – NH2, – COOH, – OH, – SH, – CO – NH –, пептидные связи и др. В результате вокруг макромолекулы образуется монослой растворителя, называемый сольватной или гидратной оболочкой. Дополнительным фактором устойчивости является наличие заряда на молекуле белка, обусловленное ионогенными группами. Растворы ВМС самопроизвольно не осаждаются. Чтобы лишить высокомолекулярные частицы устойчивости, необходимо удалить гидратную оболочку и снять электрический заряд. Одним из методов осаждения белков является высаливание.
ВЫСАЛИВАНИЕ:
Высаливание – это процесс осаждения белков с помощью концентрированных растворов солей. Для высаливания чаще всего используют соли Na2SO4, (NH4)2SO4, фосфаты. Высаливание наиболее эффективно в ИЭТ белка, что и используется для её определения. Учитывая механизм осаждающего действия электролитов и других водоотнимающих средств, немецкий биохимик Кройт предложил общую схему высаливания. Схема высаливания по Кройту. спирт, ацетон спирт, ацетон Из схемы видно, что необходимо удалить гидратную оболочку (спиртом или ацетоном) и снять заряд электролитом. Последовательность этих действий не имеет значения. Для осаждения многих белков достаточно большой концентрации одного электролита, особенно сульфатов, которые обеспечивают снятие и заряда, и дегидратацию частицы. Высаливающее действие электролитов зависит от способности их ионов гидратироваться.
Ученый Гофмейстер установил последовательность высаливающего действия анионов и катионов. Лиотропный ряд анионов: SO42–> F–> (цитрат) 3–> (тартрат) 2–> (ацетат) – >Сl– > NO3–>Br– > CNS–
Лиотропный ряд катионов: Li+>Na+> K+>Rb+>Cs+> Mg2+> Ca2+> Sr2+> Be2+ Процесс высаливания используется для приготовления некоторых лечебных сывороток и противокоревого α-глобулина, а также для разделения белков на фракции при биологических исследованиях. электролит электролит большая концентрация электролита + 6
КОАЦЕРВАЦИЯ: При снижении растворимости в растворах ВМС наблюдается коацервация – слияние гидратных оболочек нескольких частиц без объединения самих частиц. Схема коацервации: Капли или слои, образующиеся в результате коацервации, называются коацервантами.
В теории происхождения жизни на Земле, разработанной академиком А.И. Опариным, большое значение придается возникновению коацервантов из белковых молекул.
ВЯЗКОСТЬ РАСТВОРОВ ВМС. ВЯЗКОСТЬ КРОВИ. Одним из особых свойств растворов ВМС является вязкость. Вязкость (внутреннее трение) – мера сопротивления среды движению. Растворы ВМС не подчиняются основным законам вязкого течения – законам Ньютона и Туазейля, обнаруживая так называемую аномальную вязкость. Вязкость растворов ВМС очень высока в сравнении с растворами низкомолекулярных веществ. Большая вязкость растворов ВМС обусловлена их высокой гидрофильностью, макромолекулы прочно связаны с молекулами растворителя. На вязкость также влияет форма молекул. Если длинные макромолекулы расположены перпендикулярно потоку, то эффект сопротивления наибольший, если вдоль потока – сопротивление наименьшее. При увеличении давления частицы ориентируются вдоль потока и вязкость уменьшается. В более концентрированных растворах полимеров образуются пространственные структурные сетки, увеличивающие вязкость растворов. Вязкость растворов ВМС зависит от концентрации раствора. Для низкомолекулярных веществ эта зависимость выражается уравнением Эйнштейна: η = η0(1 + α С), где η – вязкость раствора, η0 – вязкость растворителя, α – коэффициент, зависящий от формы частиц, С – концентрация раствора полимера. Увеличение вязкости, связанное с изменением концентрации при растворении полимера характеризуют удельной вязкостью: Штаудингер установил следующую зависимость удельной вязкости от молекулярной массы полимера: ηуд = К М С К - константа, характерная для полимергомологического ряда, М – молекулярная масса, С – концентрация вещества в растворе. Уравнение Штаудингера используют для определения молекулярной массы биополимеров. Вязкость растворов белков зависит от величины рН. Наименьшей вязкостью растворы белков обладают в области изоэлектрической 7 точки, так как макромолекулы свернуты в плотные клубки, оказывающие наименьшее сопротивление течению жидкости.
ВЯЗКОСТЬ КРОВИ. Вязкость воды при t° = 20°C составляет 1 мПа × с, а вязкость крови в норме – 4-5 мПа × с.
При различных патологиях значения вязкости крови могут изменяться от 1,7 до 22,9 мПа × с.
Неоднородность структуры крови, специфика строения и разветвления кровеносных сосудов приводит к сложному распределению вязкости крови, движущейся по сосудистой системе. Вязкость крови зависит от многих факторов: температуры, наличия тромбоцитов и белых кровяных телец (не только при патологии). Вязкость увеличивается при сгущении крови, т.е. при потере воды. У больных с хроническими формами ишемической болезни сердца вязкость крови повышены, при физических нагрузках она уменьшается. В последние годы в медицинской практике измерение вязкости крови используется для изучения ее реологических свойств при тяжелых интоксикациях. Для измерения вязкости используют специальные приборы – вискозиметры.
КОЛЛОИДНО-ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ В РАСТВОРАХ ВМС, МЕМБРАННОЕ РАВНОВЕСИЕ ДОННАНА.
Осмотическое давление, как свойство коллигативное, зависит от числа частиц в единице объема системы. Осмотическое давление в растворах собственно коллоидов очень низкое, так как низкая концентрация частиц в растворе из-за их большого размера в сравнении с молекулами. Так, осмотическое давление 1% раствора сахарозы равно 79,46 кПа, а 1% раствор золя сульфида мышьяка – 0,0034 кПа. Осмотическое давление в растворах белков и других высокомолекулярных соединений значительно выше, чем в коллоидах. Так, 1% раствор желатины имеет давление, равное 1,02 кПа. Для очень разбавленных растворов полимеров осмотическое давление подчиняется уравнению Вант-Гоффа: C повышением концентрации осмотическое давление полимеров подчиняется более сложному уравнению: где, С – массовая концентрация ВМС, М – молекулярная масса, К – константа, зависящая от свойств растворителя. Данное уравнение используется для определения молекулярной массы полимеров. Осмотическое давление в растворах белков оказывает существенное влияние на ряд процессов в организме. Часть осмотического давления крови, обусловленная белками, называется онкотическим давлением. Оно невелико и составляет 0,5% (3,5-3,9 кПа) от общего осмотического давления крови.
 2020-10-12
2020-10-12 714
714








