Группа 27-28 Химия ЕН
Задание: Прочитать конспект, разобрать задачи, ответить на вопросы в конце конспекта.
Закон сохранения массы веществ
Закон сохранения массы веществ. Химические уравнения
В 1748 г. М.В. Ломоносов и в 1789 г. А. Лавуазье независимо друг от друга открыли закон сохранения массы веществ в химических реакциях. Этот закон формулируется так:
Масса всех веществ, которые вступают в химическую реакцию, равна массе всех продуктов реакции.
Запишем схему реакции горения метана СН4 в кислороде О2. В результате этой реакции образуются углекислый газ СО2 и вода Н2О:
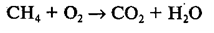
По закону сохранения массы:
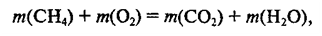

Сохранение массы веществ в химических реакциях объясняется тем, что число атомов каждого элемента до и после реакции не изменяется. В ходе химической реакции происходит только перегруппировка атомов.
В реакции в молекулах исходных веществ – СН4 и О2 – атом углерода соединяется с атомами водорода, а атомы кислорода – друг с другом; в молекулах продуктов реакции – СО2 и Н2О – и атом углерода, и атомы водорода соединяются с атомами кислорода. Легко посчитать, что для сохранения числа атомов каждого элемента в данную реакцию должны вступать 1 молекула СН4 и 2 молекулы О2, а в результате реакции должны образоваться 1 молекула СО2 и 2 молекулы Н2О:
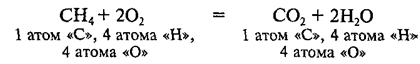
Данное выражение является уравнением химической реакции, или химическим уравнением.
Числа перед формулами веществ в уравнении реакции называются коэффициентами.
Химическое уравнение – это выражение химической реакции, в котором записаны формулы исходных веществ (реагентов) и продуктов реакции, а также коэффициенты, показывающие число молекул каждого вещества.
Если известна схема реакции, то для составления химического уравнения нужно найти коэффициенты.
Алгоритм составления уравнения химической реакции
| Составим уравнение химической реакции взаимодействия фосфора и кислорода |
| 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → |
| 2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 |
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции. · Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше. · В данном случае это атомы кислорода. · Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:  · Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции: · Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:  · Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом: · Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:  · Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен: 4P + 5O2 = 2P2O5 · Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен: 4P + 5O2 = 2P2O5 |
Составим, например, уравнение реакции, которая выражается следующей схемой:
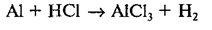
В левой части схемы атомы водорода и хлора входят в состав молекулы НСl в соотношении 1:1; в правой части схемы содержатся 3 атома хлора в составе молекулы АlСl3 и 2 атома водорода в составе молекулы Н2. Наименьшее общее кратное чисел 3 и 2 равно 6.
Напишем коэффициент «6» перед формулой НСl, коэффициент «2» - перед формулой АlСl3 и коэффициент «3» - перед формулой Н2:
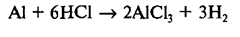
Так как теперь в правой части содержится 2 атома алюминия, напишем коэффициент «2» перед формулой Аl в левой части схемы:
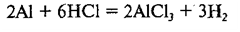
В результате мы получили уравнение данной реакции. Коэффициенты в химическом уравнении показывают не только число молекул, но и число молей исходных веществ и продуктов реакции. Например, уравнение показывает, что в реакцию вступают 2 моля алюминия Аl и 6 молей хлороводорода НСl, а в результате реакции образуются 2 моля хлорида алюминия АlСl3 и 3 моля водорода Н2.
Проверим выполнение закона сохранения массы для данной реакции:
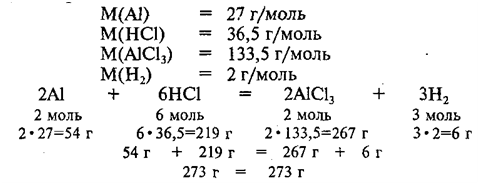
По уравнениям реакций можно производить различные расчеты.


УПРАЖНЕНИЯ
1.

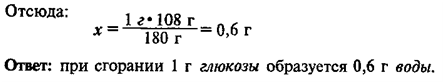
_______________________________________________________________
2.

_____________________________________________________________
 2020-10-10
2020-10-10 795
795







