Уравнение Никольского связывает относительные величины сорбции ионов А и В ионитом через константу ионного обмена данного ионита по ионам А и В.
КА/В=const при Т=const, поэтому уравнение Никольского является уравнением изотермы ионной адсорбции.
Проанализируем уравнение изотермы адсорбции Никольского для двух случаев:
1) для одновалентных ионов А и В:
т.е. ZА=ZB=1
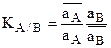 (1)
(1)
Отсюда легко установить связь КА/В с коэффициентом силективности ионов А и В – ТА/В.
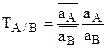
откуда КА/В=ТА/В или 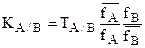 , если ТА/В выражается через концентрации, а не активности.
, если ТА/В выражается через концентрации, а не активности.
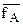 ;
; 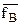 - коэффициенты активности ионов А и В в ионите.ъ
- коэффициенты активности ионов А и В в ионите.ъ
fA и fB – коэффициенты активности А и В в растворе.
Таким образом, для одновалентных ионов, константа ионного обмена данных ионов численно равна коэффициенту силективностип этих ионов.
Обозначим через 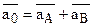
 а через а0=аА+аВ (
а через а0=аА+аВ (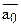 и а0 – постоянны в данной системе по закону эквивалентности ионного обмена.) и поделив выражение на
и а0 – постоянны в данной системе по закону эквивалентности ионного обмена.) и поделив выражение на 
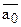 (а0), получим
(а0), получим 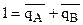 , где
, где 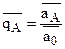 - относительная доля иона А в ионите.
- относительная доля иона А в ионите.
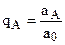 - относительная доля иона А в растворе.
- относительная доля иона А в растворе.
Тогда поделив числитель и знаменатель уравнения (1) на 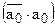 получим:
получим:
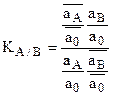 ,
, 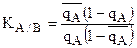 откуда можно выразить долю ионов А адсорбированных ионитом:
откуда можно выразить долю ионов А адсорбированных ионитом:
КА/В×qA-KA/B×qA×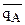 =
=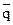 A(1-qA)
A(1-qA)
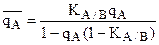 (2)
(2)
Если КА/В>>1, т.е. ТА/В>>1, т.е. ион А сорбируется значительно лучше, чем ион В, то
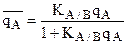 - есть не что иное, как уравнение Ленгмюра.
- есть не что иное, как уравнение Ленгмюра.
Если КА/В<<1, след. ТА/В<<1, т.е. ион А сорбируется значительно хуже, чем ион В, то
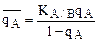 - уравнение вогнутой кривой, т.к. 0<qА<1, т.е. в координатах
- уравнение вогнутой кривой, т.к. 0<qА<1, т.е. в координатах 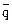 А -
А - 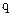 A, получим при любых значениях
A, получим при любых значениях 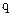 А, величина
А, величина 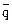 А – мала и начинает резко лишь при
А – мала и начинает резко лишь при 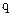 А ® 1.
А ® 1.
Рисунок
Рисунок показывает зависимость относительной доли иона А в растворе и представляет собой графическое выражение изотермы адсорбции для одновалентного иона А, находящегося в системе с одновалентным ионом В.
2) для разновалентных ионов А и В
соотношение между  ТА/В и КА/В имеет вид:
ТА/В и КА/В имеет вид:
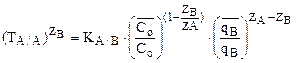 (3)
(3)
если А – двухвалентный ион, а В – одновалентный, то
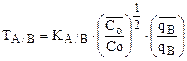 (4)
(4)
Из уравнения (4) следует, что коэффициент селективности для двухвалентного иона, обменивающегося на ионите на одновалентный, возрастает с уменьшением общей концентрации ионов в растворе – Со (т.к. 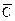 о » const), т.е. при разбавлении раствора. Для 3-х валентного иона такая зависимость еще более усиливается.
о » const), т.е. при разбавлении раствора. Для 3-х валентного иона такая зависимость еще более усиливается.
Таким образом, изотерма адсорбции двух (или трех) валентного иона из раствора на ионит, выражаемая в координатах 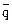 А = f(qA) будет тем более выпуклой, чем больше разбавление раствора.
А = f(qA) будет тем более выпуклой, чем больше разбавление раствора.
Графическое выражение изотермы адсорбции
на ионитах
Непосредственное применение уравнения Никольского и его преобразование для расчета изотерм адсорбции ионов на ионитах затруднительно, т.к. неизвестными остаются величины 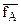 и
и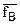 - коэффициенты активности ионов А и В ионите. В практике исследований процессов ионного обмена обычно пользуются графическим методом, который состоит в построении кривых – изотерм адсорбции иона из раствора в координатах
- коэффициенты активности ионов А и В ионите. В практике исследований процессов ионного обмена обычно пользуются графическим методом, который состоит в построении кривых – изотерм адсорбции иона из раствора в координатах 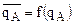 . (Такая система координат сложилась исторически и была позаимствована из теории и практики адсорбции неэлектролитов на твердых поверхностях)
. (Такая система координат сложилась исторически и была позаимствована из теории и практики адсорбции неэлектролитов на твердых поверхностях)
При этом относительные доли ионов А в ионите 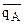 и растворе
и растворе 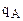 выражают в эквивалентных долях, т.е.
выражают в эквивалентных долях, т.е.
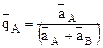 и
и 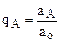
Рассмотрим несколько случаев:
1) если ионит не проявляет селективности по отношению к ионам А и В, то коэффициент селективности ТА/В = 1 и 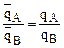 , откуда заменяя
, откуда заменяя 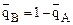 и
и 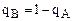
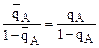
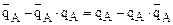
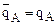 - уравнение прямой линии
- уравнение прямой линии
Рисунок
2) если ионит обладает селективностью к иону А, то ТА/В>1 и, следовательно, 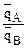 >
>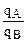 откуда
откуда 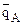 >
>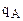 , т.е. кривая адсорбции выпуклая во всех точках отличных от 0 и 1 (в т. 0 – при
, т.е. кривая адсорбции выпуклая во всех точках отличных от 0 и 1 (в т. 0 – при 
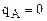
 в растворе и ионите вообще нет ионов А; при
в растворе и ионите вообще нет ионов А; при 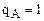 ,
, 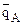 - тоже равно1, т.к. кроме ионов А никаких других нет);
- тоже равно1, т.к. кроме ионов А никаких других нет);
Рисунок
3) если ионит не обладает селективностью к иону А, а обладает селективностью к иону В, то ТА/В <1 и 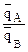 <
<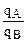 , откуда
, откуда 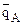 <
<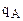 , т.е. кривая адсорбции во всех точках вогнутая;
, т.е. кривая адсорбции во всех точках вогнутая;
Рисунок
4) кроме прямых, выпуклых или вогнутых изотерм адсорбции ионов на ионите могут быть и S-образные кривые (о них несколько позже).
Изотермы адсорбции ионов из растворов на
Н-катионитах и ОН-анионитах
Н-катионитами или катионитами в Н-форме называются катиониты вида 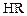 , диссоциирующие в воде (растворе) по уравнению:
, диссоциирующие в воде (растворе) по уравнению:
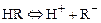 ,
,
где 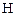 + - ионная атмосфера,
+ - ионная атмосфера, 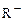 - функциональная группа.
- функциональная группа.
ОН-анионитами или анионитами в ОН-форме, называются аниониты вида 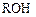 , диссоциирующие в воде (растворе) по уравнению:
, диссоциирующие в воде (растворе) по уравнению:
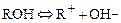
и адсорбирующие из воды анионы.
Как мы с вами установили иониты бывают:
а) монофункциональные и полифункциональные;
б) сильные и слабые (по характеру диссоциации функциональных групп).
Рассмотрим некоторые возможные случаи адсорбции:
1. Адсорбция монофункциональным сильнокислотным катионитом (сильноосновным анионитом) катиона (аниона) из раствора нейтральной соли.
Примером такого катионита является катионит КУ-2. Функциональная группа (- SО3Н). Примером нейтральной соли является NаСl. В начальный момент ионного обмена в ионной атмосфере функциональных групп ионита только ионы Н+, а в растворе только ионы Nа. Функциональная группа – SO3H, как сильная, диссоциирует полностью. По мере ионного обмена ионы Nа переходят в ионит (ионную атмосферу), а ионы Н+ - в раствор в эквивалентном количестве. И так до установления равновесия. Состояние ионообменного равновесия характеризуется КNа+/Н+ и ТNа+/Н+.
Так как катионит обладает большей селективностью к иону Nа+, чем к иону Н+ (см. ряд селективности), то изотерма адсорбции Nа имеет вид:
Рисунок
ТNа+/Н+>1 ® 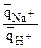 >
>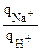 ; КNа+/Н+ = ТNа+/Н+>1;
; КNа+/Н+ = ТNа+/Н+>1;
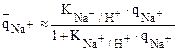
Аналогичная изотерма адсорбции имеет место при ионном обмене на сильноосновном анионите аниона нейтральной соли, например Сl из раствора NaCl.
2. Адсорбция монофункциональным слабокислотным катионитом (слабоосновным анионитом) катионов (анионов) из раствора нейтральной соли
Примером такого катионита может быть катионит – бекелитовая смола. Функциональная группа (-ОН). Примером нейтральной соли также является NaCl.
Казалось бы при ионном обмене здесь должны протекать все те же процессы, что и в первом случае, однако это не так. Слабокислотный катионит диссоциирует полностью по уравнению
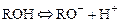
лишь в щелочной среде, т.е. при рН>7. В растворе же нейтральной соли рН»7. Поэтому диссоциация функциональных групп лишь частичная и такой катионит к иону Na+ обладает меньшей селективностью, чем к иону Н+ (ряд селективности для слабокислотных катионитов). Следовательно, ТNa+/Н+<1; КNa+/H+<1 и 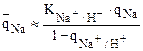
а изотерма адсорбции имеет вогнутую форму. (Аналогичная картина имеет место при адсорбции слабоосновных анионитов аниона из раствора нейтральной соли).
Рисунок
3) Адсорбция полифункциональным Н-катионитом (ОН-анионитом) катионов из раствора нейтральной соли.
Примером такого катионита является сульфоуголь. Функциональные группы (- SО3Н) и (- СООН). Примером нейтральной соли – NaCl.
В данном случае кривая адсорбции будет иметь S- образную форму. Это связано с тем, что в первой фазе обмен катионов Nа+ из раствора на катион Н+ из ионита будет происходить за счет сильнокислотных функциональных групп (- SО3Н). Диссоциация слабокислотных групп (- СООН) полностью подавлена. По мере того, как ОЕ ионита по группам (- SО3Н) истощится, а в ионите ионы Н+ заменятся на ионы Nа+ (в соответствии с КИ.О.) при дальнейшем повышении  в растворе обмен ионов Na+ из раствора на Н+ из ионита будет происходить за счет слабокислотных функциональных групп (- СООН). Этот процесс характеризуется тем, что К<1; Т<1 и кривая адсорбции примет вогнутый вид.
в растворе обмен ионов Na+ из раствора на Н+ из ионита будет происходить за счет слабокислотных функциональных групп (- СООН). Этот процесс характеризуется тем, что К<1; Т<1 и кривая адсорбции примет вогнутый вид.
Аналогично и при адсорбции анионов средних солей полифункциональными анионитами.
 2014-02-04
2014-02-04 2366
2366








