Лекция №16
Набухаемость ионитов и факторы, влияющие на нее
Ионит, помещенный в воду, набухает за счет проникновения молекул воды в объем сетки ионитов., т.е. увеличивается объем “зерен” ионита. (зерна представляют собой макромолекулы ионита). Набухаемость является важной характеристикой ионита и в паспорте каждого ионита обязательно указывается его коэффициент набухаемости. Т.е. во сколько раз увеличится объем набухшего ионита по сравнению с ионитом, находящимся в воздушно-сухом состоянии.
Набухаемость зависит от:
1. числа поперечных связей (чем меньше поперечных связей, тем больше набухаемость)
2. природы противоиона (чем больше заряд, тем меньше противоионов в ионите, тем меньше воды поглощает ионит).
Схемы работы модели набухания:
1. Полярные группы, а именно молекулы Н2О, проникают внутрь сетчатой структуры за счет действия (электростатических и осмотических сил).
2. Происходит диссоциация функциональных групп ионита за счет действия молекул воды как при обычной диссоциации, образование ионной атмосферы и гидратация противоионов.
3. Осмос ионов из ионной атмосферы в воду и из воды в ионит.
(Модель не учитывает сил взаимодействия ионов – упрощение).
Сильному набуханию способствует:
1. Незначительная степень ионизации связей в единичном радикале молекулы ионита.
2. Высокая обменная емкость ионита.
3. Насыщение ионита однозарядными противоионами.
4. Полная диссоциация функциональных групп.
5. Малая концентрация солей во внешнем растворе.
Давление набухания может достигать 1000 ат.
Иониты, являясь твердыми адсорбентами, проявляют способность к адсорбции. Из раствора электролитов и неэлектролитов не только по законам ионного обмена, а и по законам сорбции вещества на развитой твердой поверхности.
а) сильные электролиты. (для простоты рассмотрим случай, когда (противоионы) ионы в ионной атмосфере так же, как ионы в растворе.)
Пусть катионит типа RA помещен в раствор, содержащий электролит вида АУ. В растворе происходит диссоциация ионита по уравнению:
RA«R¢-+A¢+ (1)
И электролита по уравнению:
АУ®А++У- (2)
где R- и А+ - показывают что функциональная группа и ионы А+ находятся в тв. фазе ионита.
В начальный момент при образовании такой системы равновесия нет, при этом:
а) С¢у-<<Су- - концентрация У- в ионите меньше, чем в растворе.
Условие а) вызовет диффузию ионов У- из раствора в ионит, что в свою очередь приведет к усилению диссоциации ионита по уравнению (1), т.к. в ионной атмосфере увеличится количество отрицательно заряженных частиц У- и уменьшится общий положительный заряд ионной атмосферы.
Функциональная группа R- будет стремится к диффузии из ионита в раствор, но она “привязана” к матрице ионита и уйти в раствор на может.
В результате перемещения У- из раствора в ионит (в ионную атмосферу) внутри ионита (по отношению к раствору) образуется электричесикй потенциал j<0, а в растворе образуется j>0 (за счет избытка А+).
Возникновение разности потенциалов Dj способствует также перемещению катиона А+ из раствора в ионит, что ведет к уменьшению Dj., и выражает собственно адсорбцию электролита. Этот процесс идет до тех пор, пока электрохимический потенциал электролита АУ в растворе не станет равным потенциалу его в ионите.
h¢АУ=hАУр- р (hi=mi+nFj).
Таким образом, при адсорбции сильных электролитов идут процессы:
1) диссоциация RA; 2) диффузия У- из раствора в ионит; 3) увеличение j раствора (и уменьшение j в ионите); 4) адсорбция ионитом электролита АУ из раствора.
Т.к. возникающая разность потенциалов Dj за счет диффузии иона У- из раствора в ионит очень мала, то и сама адсорбция электролита очень мала.
б) неэлектролиты.
Адсорбция неэлектролитов (например, газов) происходит под действием сил межмолекулярного взаимодействия, например, Вандервальсовых сил, и носит такие же закономерности, как и при адсорбции неэлектролитов (газов) твердыми адсорбентами.
Концентрация неэлектролита в растворе (Сi) и концентрация его в ионит (С¢i) связаны через константу адсорбции Кi:
Кi=С¢i/Сi
При этом константа адсорбции неэлектролита орпеделяется такими характеристиками, как:
1. степень поперечных связей в ионите (чем больше поперечных связей, тем меньше Кi, т.е. уменьшается адсорбция, т.к. трудно проникать внутрь).
2. Структура матрицы ионита (влияет на силы межмолекулярного взаимодействия)
3. Природа противоина (чем больше заряд и меньше радиус противоина, тем больше степень гидротации противоиона молекулами воды, тем меньше К и тем меньше адсорбция неэлектролита – трудно проходить через ионную атмосферу).
4. Свойства растворенного вещества
в) адсорбция слабых электролитов +9
Механизм адсорбции такой же как и для сильного электролита, и одновременно, как у неэлектролита, так как слабый электролит присутствует в растворе в виде ионов и молекул. (НАn«Н++An-). Поэтому величина адсорбции больше, чем можно ожидать: ионы адсорбируются по типу сильных электролитов и молекулы по типу неэлектролитов.
Сильно основные аниониты поглощают слабые кислоты, как правило в количествах превышающих их обменную емкость, но за счет эффекта адсорбции молекул.
Сильно-кислотные катиониты способны поглощать слабые кислоты в кислых и нейтральных средах по механизму адсорбции неэлектролитов. Если далее на такой катионит подействовать щельчью, то слабая кислота диссоциирует (НAn«H++An-) и вымывается из катионита (т.к. он предназначен для обмена катионов). Аниониты способны поглощать слабые основания из основных растворов (рН>7). При действии кислот такие слабые основания вымываются.
Таким образом, мы рассмотрели механизмы адсорбции ионитами из раствора электролитов и неэлектролитов. Эти процессы для ионитов являются неосновными (побочными), протекают обычно в небольших количествах. В практике водоподготовки на ТЭС процессы адсорбции имеют в значительных количествах при регенерации ионитов, т.е. при восстановлении обменных свойств ионитов путем промывания катионитов раствором Н2SO4 (обычно); а анионитов – NaOH. Поэтому после регенерации ионитов всегда проводят их тщательную отмывку с целью удаления сорбированных электролитов из смолы.
Также отрицательные явления, вызванные адсорбцией на ионитах протекают при адсорбции неэлектролитов или слабых электронов, присутсвующих в обратимой на ионитах воде. Это вызывает уменьшение Е. Адсорбция молекул окислителя также вызывает уменьшение Е (потемнение ионита).
Основное же назначение ионитов – обменивать ионы из пропускаемой воды на ионы из ионита. В практике водоподготовки на ТЭС обычно на катионитах из воды поглощаются Са2+; Мg2+; Na+ а в воду поступают ионы Н+ (или Na+), а на анионитах из воды удаляются ионы SO42-; Cl-; NO3-; HCO3-; HsiO3-, а воду поступают ионы ОН-. Далее в воде ионы Н++ОН-®Н2О дают молекулы воды и таким образом, солесодержание очищаемой воды сильно понижается. А теперь перейдем к рассмотрению закономерностей ионного обмена.
Закономерности ионного обмена в статических условиях
Процесс ионного обмена на ионитах – химический процесс, подчиняющийся ряду химических закономерностей, таких как:
1. Эквивалентность ионного обмена;
2. Обратимость процессов;
3. Селективность обмена ионов;
4. Закон действия масс.
1. Эквивалентность обмена ионов
Сущность этого закона состоит в том, что понижение в растворе концентрации какого-либо иона (при ионном обмене) вызывает повышение на эквивалентную величину концентрации другого иона, поступающего в раствор из ионита. Т.е. обмен ионов происходит строго в стехиометрических количествах. Так если раствор НСl находится в контакте с анионитом, содержащем ионы ОН- (т.е. в форме ROH), то процесс обмена анионов может быть выражен уравнением:
R+½OH-+Cl-р-р«R+½Cl-+OH-р-р
Таким образом, в растворе понижается концентрация ионов Сl-, а в тоже время, на эквивалентную величину повышается конценрация ионов ОН-.
При этом в растворе могут протекать сопутствующие реакции, так для рассматриваемого примера в растворе НСl ионы Сl- уходят на анионит, а в растворе остаются ионы Н+ (НСl®H++Cl-), да поступают ионы ОН- из анионита. Тогда сопутствующей реакцией будет такая:
Н++ОН-«Н2О
В результате которой будет уменьшаться концентрация ионов водорода в растворе и, следовательно, рН раствора увеличивается.
Сопутствующие реакции наблюдаются в тех случаях, когда ионы, поступающие в раствор из ионита, образуют труднорастворимые электролиты (слабые электролиты), или комплексные соединения с ионами, находящимися в растворе. При этом имеет место видимое нарушение закона эквивалентности.)
2. Обратимость процессов ионного обмена.
Процесс обмена ионов является типичным обратимым процессом. Уравнение обмена ионов А из ионита (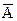 ) на ионы В из раствора (В) если валентность ионов А и В равна 1 можно записать в виде:
) на ионы В из раствора (В) если валентность ионов А и В равна 1 можно записать в виде:
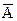 +В«А+
+В«А+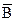 (3)
(3)
где 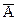 и
и 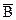 - ионы А и В в ионите; А и В – ионы А и В в растворе.
- ионы А и В в ионите; А и В – ионы А и В в растворе.
Это уравнение обратимого процесса и состояния равновесия не зависит от того справа или слева идет идет приближение к равновесию, т.е. являются ли в исходном состоянии ионами на ионите (в ионной атмосфере) ионы 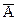 или
или 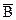 . Если
. Если 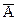 , то идем к равновесию слева, если
, то идем к равновесию слева, если 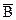 , - то справа).
, - то справа).
При этом соотношение количеств ионов А и В, адсорбированных единицей массы ионита (обозначим 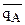 и
и 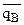 ), является функцией активности этих ионов в растворе:
), является функцией активности этих ионов в растворе:
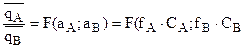
2. Силективность обмена ионов.
Рассмотрим уравнение равновесия при ионном обмене.
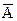 +В«А+
+В«А+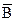
Для простоты А и В имеют валентность равную 1.
Относительное количество ионов А и В, сорбируемых ионитом (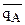 и
и 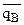 ) являются функцией не только активности их в растворе, но и природы этих ионов.
) являются функцией не только активности их в растворе, но и природы этих ионов.
Если в растворе аА/аВ=m, а на ионите 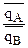 =n, то между m и n могут быть такие соотношения m<>n. Если n>m, то ион А сорбируется ионитом лучше, чем ион В, если n<m, то лучше сорбируется ион В.
=n, то между m и n могут быть такие соотношения m<>n. Если n>m, то ион А сорбируется ионитом лучше, чем ион В, если n<m, то лучше сорбируется ион В.
Способность к преимущественной адсорбции одних ионов по сравнению с другими получила название силективности. (Показать различие между понятием адсорбция электролита и адсорбция иона). Для количественного выражения селективности ионов используется показатель – коэффициент силективности Т, представляющий собой отношение числа грамм-эквивалентов того и другого ионов в ионите, поделенное на отношение их концентрацией в растворе.
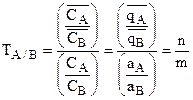
Если А и В адсорбируются одинаково, то ТА/В=1, если А – адсорбируется лучше, чем В, то ТА/В>1, а если В – лучше чем А, то ТА/В<1.
Причиной, вызывающей селективность ионного обмена является различие энергий притяжения различных ионов тв. фазой ионита, что обусловлено в первую очередь разными величинами радиуса адсорбционных ионов и их заряда. Влияние радиуса и заряда на силективность иона вытекает из закона Кулона (F=kq1q2/r2).
Т.к. в водном растворе ионы находятся в виде гидратированных частиц, то силективность иона характеризует именно радиус гидратированного иона.
Так для щелочных металлов: rLi+< rNa+< rK+ (0,78< 0,98< 1,33), но чем меньше радиус иона, тем больше степень его гидротации. Так соотношение между радиусами гидратированных ионов уже такое (обратное):: rLi+гидр< rNa+гидр< rK+гидр. Соответственно с таким соотношением радиусов гидратированных ионов, ряд силективности для щелочных металлов выглядит так:
Li+< Na+ <К+, т.е. калий сорбируется катионитом лучше, чем Na+ и лучше, чем Li+.
Для щелочно-земельных металлов соотношение радиусов такое
rMg2+< rCu2+< rSr2+< rВа2+,(0,78< 1,06< 1,27< 1,43) а в гидратированном состоянии rMg2+гидр< rCu2+гидр< rSr2+гидр< rВа2+гидр, поэтому ряд силективности для этих ионов выглядит так:
Mg2+< Ca2+< Sr2+< Ba2+, т.е. Mg2+ адсорбируется ионитом хуже всех, а Ва2+ - лучше всех (из этих ионов).
Из закона Кулона также следует, что ионы большей валентностью адсорбируются лучше, чем ионы с меньшей валентностью. Тогда для ионов, присутствующих обычно в природных водах, которая идет на ХВО ТЭС, ряды силективности выглядят так:
Для катионов: (Н+) Na+< K+»NH4+< Mg2+< Ca2+< Al3+
Для анионов: (ОН-) Сl-< Br-< NO3-< SO42-
Ион ОН- для сильноосновных анионионитов адсорбируется хуже хлора для слабоосновных – он помещается в конце ряда.
Для сильнокислотных катионов ион Н+ адсорбируется хуже Na+.
4. Закон действия масс. Изотерма адсорбции.
Если валентность хотя бы одного из ионов А и В, участвующих в ионном обмене не равна 1 (общий случай), то уравнение, выражающее равновесие ионного обмена запишется в таком виде:
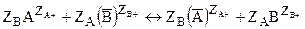
где ZA и ZB – стехиометрические коэффициенты в уравнении, равные валентностям ионов А и В.
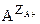 - ион А, с валентностью ZA+, находящийся в ионите (в ионной атмосфере); аналогично
- ион А, с валентностью ZA+, находящийся в ионите (в ионной атмосфере); аналогично 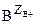 и
и  .
.
Например: 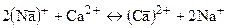
Т.е если из ионита в раствор выходят 2 иона Na+, то по закону эквивалентности в ионите сорбируется лишь один ион Са2+, т.к. ЭNa+=MNa+, а 1ЭСа2+=1/2МСu2+.
Для уравнения (3), как для всякого уравнения, описывающее равновесие химического процесса справедлив закон действия масс.:
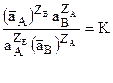 (4)
(4)
где а – активность ионов, а К – константа равновесия.
Извлекая корень степени (ZAZB) из обеих частей получим
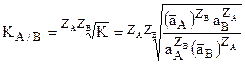
откуда 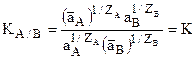 или
или
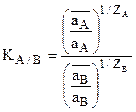
Это уравнение носит название уравнения Никольского для константы ионного обмена. (оно может быть получено и термодинамическим расчетом).
 2014-02-04
2014-02-04 1737
1737








