Химические свойства
1. Растворы оснований за счет ионов ОН– изменяют окраску индикаторов: лакмуса – на синюю, фенолфталеина – на малиновую, метилового оранжевого – на желтую.
2. Щелочи устойчивы к нагреванию. Большинство же нерастворимых оснований при нагревании разлагается. Например: Cu(OH)2 ® СuO + Н2О.
3. Основания взаимодействуют с кислотами (реакция нейтрализации):
КОН(р-р) + НСl(р-р) ® КСl(р-р) + Н2О(ж); ОН– (р-р) + Н+(р-р) ® Н2О(ж).
4. Щелочи реагируют с кислотными и амфотерными оксидами:
СО2 + Са(ОН)2 ® СaCO3 + H2O; CO2 + 2OH– + Ca2+ ® CaCO3 + H2O
Другие примеры – см. в разделе «Химические свойства оксидов».
5. Щелочи реагируют с солями:
CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4; Cu2+ + 2OH– ® Cu(OH)2
6. Щелочи реагируют с амфотерными гидроксидами:
Al(OH)3(т) + 3NaOH(р-р) ® Na3[Al(OH)6](р-р); Al(OH)3(т) + 3ОH– (р-р) ® [Al(OH)6]3–(р-р).
2NaOH + Zn(OH)2 ® Na2[Zn(OH)4]; 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
7. Реакции щелочей в растворе с некоторыми неметаллами и переходными металлами:
2NaOH +Cl2 ® NaCl + NaClO + H2O 3KOH +4Pбел + 3H2O ® PH3 + KH2PO2
2NaOH +Si + H2O ® Na2SiO3 + H2 6KOH +2Al + 6H2O ® 2K3[Al(OH)6] + 3H2.
Таким образом, основания проявляют свои характерные свойства в растворах за счет гидроксид-ионов.
3. Кислоты. В свете теории электролитической диссоциации кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода:
НС1 ⇄ Н+ + Сl–; HNO3 ⇄ H+ + NO3–.
Классификация. Кислоты классифицируют:
I. По составу: кислородсодержашие (HNO3, H2SO4 и др.) и бескислородные (растворы HF, HCl, HBr, HI, H2S и др.).
II. По основности (основность кислоты определяется числом молей ионов водорода, образующимся при диссоциации 1 моль кислоты при допущении, что степень диссоциации равна 1, или 100%): НС1, НNО3, – одноосновные, Н2S, Н2СО3, Н2SO4 – двухосновные, Н3РО4, Н3ВО3 – трехосновные кислоты.
Двух- и многоосновные кислоты диссоциируют ступенчато.
1. Взаимодействие кислотных оксидов с водой (только для растворимых кислородсодержащих кислот): SO3 + Н2О ® H2SO4.
2. Окисление некоторых простых веществ:
3Р + 5HNO3(30%-ный р-р) + 2Н2О ® 3Н3РО4 + 5NО.
3. Взаимодействие солей с кислотами (действуют сильной кислотой на соль слабой или летучей кислоты): NaNO3(т) + H2SO4(конц.) 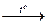 NaHSO4 + HNO3;
NaHSO4 + HNO3;
Na2SiO3(р-р) + H2SO4(р-р) ® Na2SO4(р-р) + H2SiO3(т), SiO32–(р-р) + 2H+(р-р) ® H2SiO3(т).
NaCl(т) + H2SO4(конц) ® NaHSO4(т) +HCl
4. Бескислородные кислоты можно получить взаимодействием водорода с неметаллами с последующим растворением продукта реакции в воде: Н2(г) + Сl2(г) 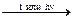 2НСl(г).
2НСl(г).
Физические свойства. При обычных условиях кислоты могут быть твердыми веществами (Н3РО4, Н3ВО3 и др.), жидкими (HNO3, Н2SО4 и др.) или растворами газов в воде (HCl, HBr, HI, H2S).
Некоторые кислоты (HNO2, H2SO3, H2CO3) существуют только в разбавленных растворах. В чистом виде при комнатной температуре они не могут быть выделены, поскольку распадаются на ангидрид (оксид, соответствующий кислородсодержащей кислоте) и воду.
Большинство кислот хорошо растворимы в воде; растворы их имеют кислый вкус, разъедают животные и растительные ткани.
 2014-02-05
2014-02-05 795
795








