1. Конфигурационная изомерия.
1.1. Геометрическая изомерия. Характерна для соединений, имеющих в составе молекулы двойную связь или цикл и около них одинаковые атомы или группы атомов. Примеры:
1) СН3–СН=СН–СН3 бутен-2. Для этого вещества характерны два геометрических изомера:

цис-бутен-2 транс-бутен-2
2) Для циклопропандикарбоновой кислоты также характерны два геометрических изомера:
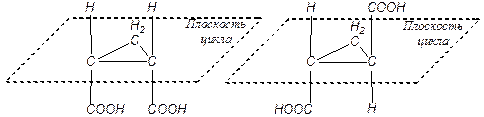
цис-циклопропандикарбоновая кислота транс-циклопропандикарбоновая кислота
Могут быть и другие виды пространственной изомерии, не рассматривающиеся в школьном курсе химии.
III. Таутомерия – вид изомерии, при которой одно и то же вещество существует в виде нескольких форм, находящихся в состоянии динамического равновесия. Примеры:
1). Кольчато-цепная таутомерия глюкозы:
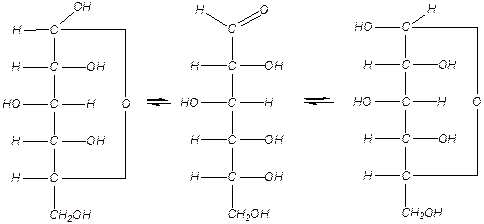
a-глюкоза открытая, альдегидная форма глюкозы b-глюкоза
2). Кето-енольная таутомерия (енолы – это соединения, содержащие в молекулах гидроксильную группу и двойную связь):
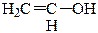 ⇄
⇄ 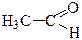
виниловый спирт (енольная форма) уксусный альдегид (кетоформа);
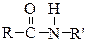 ⇄
⇄ 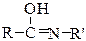
кетоформа пептидной связи енольная форма пептидной связи
Задания для самостоятельной работы
2.28. Какое из утверждений соответствует теории А. М. Бутлерова?
1) Строение вещества определяет его свойства;
2) все вещества имеют постоянный качественный и количественный состав;
3) все вещества состоят из молекул;
4) органические вещества образуются только в природе.
2.29. Углерод в органических соединениях проявляет валентность: 1) I; 2) II; 3) III; 4)IV.
2.30. Многообразие углеводородов объясняется тем, что атомы:
1) углерода могут иметь любую степень окисления от –4 до +4;
2) углерода могут образовывать устойчивые цепи;
3) водорода могут иметь любую степень окисления от –1 до +1;
4) водорода могут образовывать устойчивые цепи.
2.31. Число структурных изомеров состава С4Н8 равно: 1) 5; 2)2; 3) 3; 4) 4.
2.32. Установите соответствие между структурной формулой вещества и названием его гомологического ряда.
ФОРМУЛА ВЕЩЕСТВА ГОМОЛОГИЧЕСКИЙ РЯД
1) С6Н5–СН2–СН3 А) алкадиены
2) СН2–С(СН3)2–СН2–СН3 Б) алканы
3) СН2=С=СН–СН3 В) арены
4) СН3–С≡С–СН3 Г) алкены
Д) алкины
2.33. К структурным изомерам относятся:
1) бензол и циклогексан 3) пентен-1 и циклопентан
2) этаналь и диметиловый эфир 4)аминобензол и анилин
2.34. Гомологами являются:
1) метан и пропан 3) бутен-1 и бутадиен-1,3
2) бутин-1 и бутен-1 4) этан и циклопропан
2.9. Общая характеристика металлов главных подгрупп I–III групп в связи с их положением в периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Металлы. Положение металлов в периодической системе химических элементов Д. И. Менделеева
Если в периодической системе элементов провести диагональ от Ве к Аt, то справа вверх от диагонали будут находиться элементы-неметаллы (исключая элементы побочных подгрупп), а слева внизу – элементы-металлы (к ним же относятся элементы побочных подгрупп). Элементы, расположенные вблизи диагонали (например, Ве, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером, хотя по физическим свойствам относятся к металлам. Это переходные металлы.
Таким образом, к элементам-металлам относятся s-элементы I и II групп (кроме Н), все d- и f-элементы, а также р-элементы III группы (кроме В), IV группы (Ge, Sn, Pb), V группы (Sb, Bi) и VI группы (Ро). Как видно, наиболее типичные элементы-металлы расположены в начале периодов (начиная со второго).
Строение атомов металлов. Металлическая связь
Металлическая связь – это связь в металлах.
Атомы большинства металлов на внешнем электронном слое содержат небольшое число электронов, поэтому у них имеется избыток валентных атомных орбиталей (АО) и недостаток электронов. Например, у атома натрия:
Na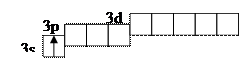
При сближении атомов валентные АО соседних атомов перекрываются, благодаря чему электроны свободно перемещаются от одного атома к другому, осуществляя связь между всеми атомами кристалла по обменному механизму.
Кроме того, атомы металла, катионы (образовавшиеся в результате «перехода» электрона к другому атому) и электроны удерживаются за счет сил электростатического притяжения (электростатический механизм).
Металлическая связь сильно делокализована, т.е. не закреплена между отдельными атомами, как ковалентная и ионная. Она определяет свойства металлов.
Кристаллическая решетка металлов называется металлической.
Физические свойства металлов
Физические свойства металлов можно разделить на 2 группы – общие свойства и свойства, по которым металлы различаются:
| № п/п | Свойство | Причины проявления свойства | Примеры. Исключения |
| I. Общие свойства | |||
| Металлический блеск | Наличие «свободных» электронов (отражают фотоны – частицы (кванты) света) | Наибольшая отражательная способность у Ag и In. Они используются для изготовления зеркал, рефлекторов в оптических приборах и т. д. Al и Mg отражают радиоволны, используются в радиолокации | |
| Непрозрачность | |||
| Серебристо-белый цвет | Исключения: Cu – красная, Au – желтое, Bi – имеет красноватый оттенок | ||
| Металлы – твердые вещества | Тип связи | Исключение – Hg, ее Тпл. = –39оС | |
| Пластичность | Пластичность металлов уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe. Au можно прокатывать в листы толщиной не более 0,003 мм | ||
| Электрическая проводимость | Электрический ток – направленное движение заряженных частиц (электронов) | Электрическая проводимость убывает в ряду Ag, Cu, Au, Al, Mg, Zn, Fe, Pb, Hg. С повышением температуры электрическая проводимость металлов уменьшается. Вблизи 0К наблюдается явление сверхпроводимости | |
| Теплопроводность | Высокая подвижность «свободных» электронов и колебательные движения атомов | Наибольшая теплопроводность – у Ag и Cu, наименьшая – у Bi и Hg | |
| II. Свойства, по которым металлы различаются | |||
| Плотность | Чем меньше атомная масса и чем больше радиус атомов, тем меньше плотность | Самый легкий металл – Li (r = 0,53 г/см3), самый тяжелый – Os (r = 22,6 г/см3). Металлы с r < 5 г/см3 называются легкими, остальные – тяжелыми | |
| Температуры плавления и кипения | Различная прочность химической связи между атомами | Самый легкоплавкий металл – Hg; Тпл.(Cs) = 29оС; Тпл.(Ga) = 29,8оС. Самый тугоплавкий металл – W (Тпл. = 3390оС). Металлы, Тпл. которых больше 1000оС – тугоплавкие, остальные – легкоплавкие | |
| Твердость | Самый твердый металл – Сr (царапает стекло), самые мягкие – щелочные металлы и In (режутся ножом) | ||
| Отношение к магнитным полям | – ферромагнитные – способны намагничиваться при действии слабых магнитных полей; | Fe, Co, Ni, Gd | |
| – парамагнитные – проявляют слабую способность к намагничиванию; | Al, Cr, Ti, большинство лантаноидов | ||
| – диамагнитные – не притягиваются к магниту или отталкиваются от него | Bi, Sn, Cu |
Основные способы получения металлов
Отрасль промышленности, производящая металлы, и наука о промышленных способах получения металлов и сплавов из природного сырья называются металлургией.
Горные породы, содержащие самородные металлы и соединения, пригодные для промышленного производства металлов, называются металлическими рудами. Различают руды:
– оксидные (простые: рутил ТiО2, пиролюзит МnО2, касситерит SnО2 и др.; сложные: магнетит Fе3О4, хромит Fе(СrО2)2 и др.);
– карбонатные (магнезит МgСО3, сидерит FеСО3, малахит (СuОН)2СО3 и др.);
– сульфидные (пирит FеS2, халькопирит СuFеS2, сфалерит ZnS, галенит PbS и др.);
– галогенидные (галит NaCl, сильвин KCl, карналлит KCl×MgCl2×6Н2О и др.).
Металлургия – сложное производство, в котором можно выделить 4 основные стадии:
| 1 стадия | Подготовка металлических руд: - измельчение, - сортировка по крупности, - обогащение (флотация, магнитная сепарация), - обжиг сульфидных руд (перевод сульфидов в оксиды) |
| 2 стадия | Собственно металлургический процесс – восстановление металла методами: - пирометаллургии, - электрометаллургии, - гидрометаллургии |
| 3 стадия | Очистка металлов от вредных примесей: - электролиз, - зонная плавка, - перегонка |
| 4 стадия | Обработка полученного металла: - механическая, - термическая, - химическая |
Основной процесс металлургии – восстановление металлов из соединений – можно выразить уравнением: Меn+ + nе = Ме0.
Частные случаи восстановления:
I. Восстановление металлов из руд при высокой температуре называют пирометаллургией. В пирометаллургии выделяют:
1. Восстановление металлами (металлотермия). Например:
3Fе3О4 + 8Аl = 9Fе + 4Аl2О3 (алюминотермия);
ТiСl4 + 2Мg = Тi + 2МgСl2 (магниетермия).
2. Восстановление неметаллами и их соединениями – коксом, водородом, оксидом углерода (II), метаном. Например:
РbО + С = Рb + СО;
| 3Fе2О3 + СО = 2Fе3О4 + СО2 | доменный процесс |
| Fе3О4 + СО = 3FеО + СО2 | |
| FеО + СО = Fе + СО2 |
WО3 + 3Н2 = W + 3Н2О.
II. Электрометаллургией называют получение металлов электролизом расплавов (для наиболее активных) или растворов солей. Например:
MgCl2(расплав) 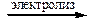 Mg + Cl2; CuCl2(р-р)
Mg + Cl2; CuCl2(р-р) 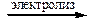 Cu + Cl2.
Cu + Cl2.
III. Гидрометаллургией называют метод выделения металлов из растворов, включающий предварительную обработку руды тем или иным реагентом для перевода металла в раствор. Например, руду, содержащую карбонат гидроксомеди (II) (СuОН)2СО3 (малахит) обрабатывают раствором серной кислоты: (СuОН)2СО3 + 2Н2SО4 = 2СuSО4 + 3Н2О + СО2.
Из полученного раствора металл выделяют либо электролизом, либо действием металлического железа: Fе + СuSО4 = Сu + FеSО4.
В гидрометаллургии возможна подземная переработка руд, при которой жидкий реагент закачивается в пласт через одну скважину, а через другую на поверхность выкачивается раствор соли металла.
Химические свойства металлов
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы (катионы). Поэтому металлы являются восстановителями.
1. Окисление ионами водорода Н+ (взаимодействие с кислотами):
Zn + 2HCl ® ZnCl2 + H2;
Zn – 2e ® Zn2+ – восстановитель; 2Н+ + 2е ® Н2 – окислитель.
Обратите внимание! С азотной и концентрированной серной кислотами металлы реагируют по-другому.
2. Окисление водой: 2Na + 2H2O ® 2NaOH + H2;
Na – 1e ® Na+ – восстановитель; 2H2O + 2e ® 2OH– + Н2 – окислитель.
3. Окисление ионами других металлов (взаимодействие с водными растворами солей менее активных металлов): Fe + CuSO4 ® FeSO4 + Cu;
Fe – 2e ® Fe2+ – восстановитель; Cu2+ + 2e ® Cu – окислитель.
4. Окисление растворами щелочей (для переходных металлов):
Zn + 2NaOH + 2H2O ® Na2[Zn(OH)4] + H2
5. Взаимодействие с неметаллами:
– с кислородом: 2Mg + O2 ® 2MgO
– с хлором: 2Fe + 3Cl2 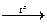 2FeCl3
2FeCl3
– с серой: Fe + S 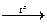 FeS
FeS
– с азотом при нагревании: 3Mg + N2 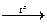 Mg3N2 (Li реагирует с N2 при комнатной температуре)
Mg3N2 (Li реагирует с N2 при комнатной температуре)
– с фосфором: 3Ca + 2P 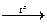 Ca3P2
Ca3P2
Мерой активности металлов является ряд стандартных электродных потенциалов (ряд напряжений) металлов.
Ряд стандартных электродных потенциалов металлов
Ряд стандартных электродных потенциалов (электрохимический ряд напряжений) металлов – это последовательность, в которой металлы располагаются в порядке убывания их восстановительной способности по отношению к ионам, находящимся в растворах.
По-другому, ряд напряжений – это ряд металлов, составленный по возрастанию алгебраического значения их стандартных электродных потенциалов:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Ni, Sn, Pb, H, Bi, Sb, Cu, Hg, Ag, Pt, Au.
Прообразом ряда напряжений был «вытеснительный ряд» Н. Н.Бекетова (1899 г.).
Стандартным электродным потенциалом называется разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л и стандартным водородным электродом, потенциал которого принимается равным 0 В. Металлы до водорода имеют отрицательные значения стандартных электродных потенциалов, а после водорода – положительные. Электродные потенциалы щелочных и щелочноземельных металлов рассчитываются теоретически, т.к. эти металлы в водных растворах реагируют с водой.
Чем левее расположен металл в ряду напряжений, тем он активнее, тем более сильным восстановителем он является, тем труднее восстановить до металла его катион.
Положение металлов в электрохимическом ряду не соответствует изменению активности металлов в группах и периодах периодической системы.
Начинает ряд напряжений литий, в то же время по периодической системе калий активнее лития. Объяснить это несоответствие можно так. При сравнении металлической активности в группах анализируют энергии ионизации металлов в вакууме: тот металл более активен, у которого энергия ионизации атомов меньше. В электрохимическом ряду металлы расположены в порядке уменьшения активности, т.е. увеличения энергии ионизации, но не в вакууме, а в водных растворах. Если в вакууме образование катиона заканчивается отрывом электрона от атомов металлов, то в водном растворе образовавшиеся катионы гидратируются, что сопровождается выделением энергии. Следовательно, энергия ионизации атома в растворе включает сумму двух величин: энергии ионизации (затрата энергии) и энергии гидратации (выделение энергии). Энергия гидратации катиона тем больше, чем больше заряд и меньше радиус при одинаковом заряде. Радиус иона лития меньше радиуса иона калия. Расчеты показывают, что на отрыв электрона от атома лития затрачивается меньше энергии, чем на отрыв электрона от атома калия. Поэтому литий в этих условиях оказывается активнее калия.
На основании ряда напряжений можно сделать некоторые важные выводы о химической активности металлов.
1. Каждый металл вытесняет из растворов солей другие металлы, стоящие за ним в ряду напряжений.
2. Металлы, стоящие в ряду напряжений до водорода способны вытеснять водород из растворов кислот (кроме азотной).
3. Металлы от лития по натрий включительно быстро окисляются кислородом воздуха при обычной температуре; металлы от магния по ртуть включительно медленно окисляются кислородом воздуха при обычной температуре или окисляются при нагревании; остальные металлы не окисляются кислородом воздуха.
4. Металлы от лития по натрий включительно взаимодействуют с водой при обычной температуре с образованием соответствующего гидроксида и водорода; металлы от магния до водорода взаимодействуют с водой при нагревании с образованием соответствующего оксида и водорода; остальные металлы водород из воды не вытесняют.
Самые активные металлы (от лития по натрий включительно) в любых водных растворах взаимодействуют прежде всего с водой.
На экзаменах типичной ошибкой абитуриентов является написание уравнений реакций вытеснения щелочным или щелочноземельным металлом менее активного металла из растворов солей (например, СuSО4 + + 2Nа = Nа2SО4 + Сu).
На практике натрий взаимодействует с водой, а затем полученная щелочь реагирует с сульфатом меди (II) с образованием осадка гидроксида меди (II) голубого цвета.
Очень часто абитуриенты пишут уравнения реакций щелочных и щелочноземельных металлов с соляной кислотой. Но т.к. соляная кислота содержит максимум 37% хлороводорода, эти металлы взаимодействуют с водой, а образовавшаяся щелочь нейтрализует кислоту.
5. Нитраты металлов от лития по натрий включительно разлагаются при нагревании с образованием нитритов и кислорода: 2NаNО3 = 2NаNО2 + О2;
Нитраты металлов от магния по медь включительно разлагаются при нагревании с образованием оксида металла, оксида азота (IV) и кислорода: 2Рb(NО3)2 = 2РbО + 4NО2 + О2;
Нитраты остальных металлов разлагаются при нагревании с образованием металла, оксида азота (IV) и кислорода: 2АgNО3 = 2Аg + 2NО2 + О2.
6. По ряду напряжений определяют последовательность восстановления металлов на катоде при электролизе растворов. (См. соответствующий раздел).
Расплавам солей соответствует другой вытеснительный ряд: Cs, Rb, K, Na, Li, Ba, Sr, Ca, Mg, Be, Al, Mn, Cr, Zn, Fe, Cd, Co, Ni, Sn, Pb, Cu, Ag, Hg, Au.
Задания для самостоятельной работы
2.35. Бериллий и магний не относятся к щелочноземельным металлам, так как:
1) свойства их гидроксидов отличаются от свойств гидроксидов щелочноземельных металлов;
2) являются переходными элементами;
3) относятся к неметаллам;
4) имеют небольшое число электронных слоев.
2.36. В схеме превращений Na 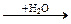 X1
X1 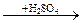 X2
X2 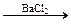 X3 веществами Х1, Х2, Х3 являются соответственно:
X3 веществами Х1, Х2, Х3 являются соответственно:
1) Na2O, Na2SO4, NaOH; 3) Na2O, Na2SO4, BaSO4;
2) Na2O2, NaOH, BaSO4; 4) NaOH, Na2SO4, BaSO4;
2.37. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Zn → ZnSO4 → Zn(NO3)2 → Zn(OH)2 → Na2[Zn(OH)4] → ZnCl2.
2.38. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Al→Al2(SO4)3→Al2O3→AlCl3→Na[Al(OH)4]→Al(OH)3
2.10. Медь, хром, железо – металлы побочных подгрупп
Железо
Строение атома и положение в периодической системе. Заряд ядра атома железа +26, в ядре 26 р и 30 n, а в электронной оболочке – 26 е. Аr(Fe) = 56. 26 е располагаются на 4-х энергетических уровнях (на это указывает номер периода). Символ элемента находится в побочной подгруппе, т. к. Fe – элемент d-семейства (у его атомов заполняется электронами d-подуровень предвнешнего уровня, а на внешнем уровне – 2 е). Электронная формула атома Fe: 1s22s22p63s23p63d64s2. Распределение электронов по энергетическим уровням и подуровням в атоме железа говорит о том, что этот элемент проявляет переменную валентность. Рассмотрим валентные возможности атома железа:
    4р – – – 4s 4р – – – 4s | 4р |
| 4р |
Наиболее характерны для железа валентности II и III, менее характерны валентности VI и VIII.
Распространенность в природе. Железо – четвертый по распространенности в земной коре элемент (после О, Si и Al) и наиболее распространенный из тяжелых металлов. В природе химический элемент железо находится в связанном виде: входит в состав горных пород, природных вод, содержится в живых организмах. Важнейшие руды железа – магнетит (магнитный железняк) Fe3O4 (FeIIFe2IIIO4), гематит (красный железняк) Fе2О3, лимонит (бурый железняк) Fе2О3×nН2О, сидерит (шпатовый железняк) FеСО3, пирит (железный или серный колчедан) FеS2.
Характеристика простого вещества. Как любой металл, железо имеет металлическую кристаллическую решетку, поэтому обладает общими свойствами металлов.
Железо – серебристо-белый, пластичный, относительно мягкий, достаточно тяжелый металл. Легко подвергается ковке, прокатке и другим видам обработки. Проявляет магнитные свойства: притягивается магнитом и само намагничивается и размагничивается (ферромагнетик).
В химическом отношении железо весьма активно. Оно взаимодействует с простыми веществами:
– с галогенами при нагревании. Железная проволока, нагретая до красного каления, горит в атмосфере хлора: 2Fе + 3Сl2 = 2FеСl3.
Аналогично протекают реакции с другими галогенами, но при переходе Cl2 ® Br2 ® I2 – все менее бурно. В случае реакции с I2 образуется FeI2.
– с кислородом. При обычной температуре оно очень медленно окисляется кислородом воздуха, однако накаленное железо легко сгорает с образованием оксида железа (II, III), или железной окалины: 3Fе + 2О2 = Fе3О4.
В присутствии влаги окисление железа на воздухе происходит быстрее, и оно ржавеет, т.е. покрывается слоем гидратированного железа (III): 4Fе + 3О2 + nН2О ® 2Fе2О3×nН2О.
Образующийся слой ржавчины – хрупкий и рыхлый, пористый, поэтому не предохраняет металл от дальнейшей коррозии.
– с серой: Fe + S ® FeS + Q
Если смесь порошков Fe и S локально нагреть (для инициации реакции), то реакция распространяется на весь объем смеси и поддерживается за счет выделяющегося тепла.
– с углеродом при нагревании: 3Fe + C ® Fe3С (карбид железа, или цементит).
Железо взаимодействует и со сложными веществами.
Железо сравнительно легко реагирует с растворами кислот, не проявляющих окислительных свойств аниона, с выделением Н2 и образованием Fе2+:
Fе + 2НСl ® FеСl2 + Н2, Fе + 2Н+ ® Fе2+ + Н2.
Разбавленная HNO3 окисляет железо до степени окисления +3:
Fe + 4HNO3(разб.) ® Fe(NO3)3 + NO + 2H2O, Fe + 4H+ + NO3– ® Fe3+ + NO + 2H2O.
Под действием концентрированных H2SO4 и HNO3 при комнатной температуре железо пассивируется: на его поверхности образуется прочная оксидная пленка, препятствующая дальнейшему взаимодействию. Это позволяет использовать стальные цистерны для транспортировки концентрированной H2SO4. Однако при нагревании железо реагирует с этими кислотами:
2Fе + 6Н2SО4(конц.) 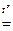 Fе2(SО4)3 + 3SО2 + 6Н2О, 2Fе + 12Н+ + SО42- = 2Fе3+ + 3SО2 + 6Н2О;
Fе2(SО4)3 + 3SО2 + 6Н2О, 2Fе + 12Н+ + SО42- = 2Fе3+ + 3SО2 + 6Н2О;
Fе + 6НNО3(конц.) 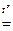 Fе(NО3)3 + 3NО2 + 3Н2О, Fе + 6Н+ + 3NО3- = Fе3+ + 3NО2 + 3Н2О.
Fе(NО3)3 + 3NО2 + 3Н2О, Fе + 6Н+ + 3NО3- = Fе3+ + 3NО2 + 3Н2О.
Щелочи не действуют на железо.
Железо реагирует с растворами солей металлов, расположенных в ряду стандартных электродных потенциалов правее: Fe + CuSO4 ® FeSO4 + Cu.
При высоких температурах железо реагирует с CО2 и Н2О:
Fe + CO2 ⇄ FeO + CO; 3Fe + 4H2O(г) ⇄ Fe3O4 + 4H2.
Соединения железа. Железо обладает небольшой электроотрицательностью, поэтому в соединениях оно проявляет положительные степени окисления. В зависимости от проявления степеней окисления для железа наиболее характерны четыре ряда соединений – соединения железа II, III, VI и VIII. Наиболее устойчивыми являются соединения железа (III). Соединения шестивалентного железа неустойчивы и встречаются крайне редко, это например, ферраты калия и бария К2FeО4 и ВаFeО4. Соединения железа (VIII) не получены.
Соединения железа (II). Оксид железа (II) FeO – твердое вещество черного цвета, нерастворимое в воде, получается при термическом разложении карбоната или гидроксида железа (II) без доступа воздуха: FeCO3 ® FeO + CO2; Fe(OH)2 ® FeO + Н2О.
FeO – основной оксид, взаимодействует с кислотами. При высоких температурах он окисляется кислородом: 4FeO + O2 ® 2Fe2O3, или 6FeO + O2 ® 2Fe3O4.
Водород и СО восстанавливают FeO при высоких температурах:
FeO + H2 ⇄ Fe + H2O; FeO + CO ⇄ Fe + CO2.
Гидроксид железа (II) получают в виде студенистого светло-зеленого осадка при действии щелочей на растворы солей железа (II): FeCl2 + 2NaOH ® Fe(OH)2¯ + 2 NaCl.
Fe(OH)2 – основной оксид, взаимодействует с кислотами. На воздухе он легко окисляется:
4Fe(OH)2 + O2 + 2H2O ® 4Fe(OH)3.
При этом цвет осадка становится все более темным серо-зеленым, а при полном окислении – коричневым.
Соли железа (II) также легко окисляются:
6FeSO4 + 3NaClO + 3H2O ® 2Fe2(SO4)3 + 2Fe(OH)3 + 3NaCl;
4FeSO4 + O2 + 2H2O ® 4(FeOH)2SO4.
Так как Fe(ОН)2 – основание средней силы, соли железа (II) в водных растворах слабо гидролизованы.
Соединения железа (III). Оксид железа (III) Fe2O3 – твердое вещество красно-бурого цвета, нерастворимое в воде. Получают его либо термическим разложением гидроксида железа (III), либо окислением тонкого порошка металлического железа:
2Fe(OH)3 ® Fe2O3 + 3H2O; 4Fe + 3O2 ® 2Fe2O3.
Fe2O3 проявляет слабые амфотерные свойства с преобладанием основных:
Fe2O3 + 6HCl ® 2FeCl3 + 3H2O; Fe2O3 + 2NaOH  2NaFeO2 + H2O.
2NaFeO2 + H2O.
феррит натрия
Fe2О3 является окислителем средней силы:
2Al + Fe2O3 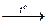 2Fe + Al2O3; Fe2O3 + CO
2Fe + Al2O3; Fe2O3 + CO 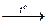 2FeO + CO2.
2FeO + CO2.
Гидроксид железа (III) получают в виде бурого студенистого осадка действием щелочей на растворы солей железа (III): FeCl3 + 3NaOH ® Fe(OH)3 + 3NaCl.
Fe(ОН)3 проявляет амфотерные свойства (с преобладанием основных):
Fe(OH)3 + 3HCl ® FeCl3 + 3H2O; Fe(OH)3 + 3KOH(конц.) ® K3[Fe(OH)6]
гексагидроксоферрат(III) калия
Fe(OH)3 – более слабый электролит, чем Fe(OH)2, поэтому соли железа (III) сильно гидролизуются, а со слабыми кислотами Fe(OH)3 солей не образует. Гидролизом объясняется и цвет растворов солей железа (III): несмотря на то, что ион Fe3+ почти бесцветен, содержащие его растворы окрашены в желто-бурый цвет, что объясняется присутствием гидроксоионов железа:
Fe3+ + H2O ⇄ FeOH2+ + H+; FeOH2+ + H2O ⇄ Fe(OH)2+ + H+;
Fe(OH)2+ + H2O ⇄ Fe(OH)3 + H+.
Соли железа (III) проявляют окислительные свойства:
Mg + 2FeCl3 ® MgCl2 + 2FeCl2; 2FeCl3 + 6KI ® 2FeI2 + I2 + 6KCl.
Двойной оксид железа Fe3O4 – твердое вещество черного цвета с ферромагнитными свойствами, нерастворимое в воде. Он может быть получен окислением металла кислородом воздуха или парами воды при высокой температуре:
3Fe + 2O2 ® Fe3O4; 3Fe + 4H2O ® Fe3O4 + 4H2.
Этот оксид реагирует с кислотами, образуя одновременно соли железа (II) и (III):
Fe3O4 + 8HCl ® 2FeCl3 + FeCl2 + 4H2O.
Соединения железа (VI). Если нагревать стальные опилки или оксид железа (III) с нитратом и гидроксидом калия, то образуется сплав, содержащий феррат калия – соль железной кислоты: Fe2O3 + 4KOH + 3KNO3 ® 2K2FeO4 + 3KNO2 + 2H2O.
Ферраты – кристаллические вещества, обычно красного цвета. Все ферраты – очень сильные окислители: 2K2FeO4 + 2NH3×H2O ® 2Fe(OH)3 + N2 + 4KOH.
Ферраты термически неустойчивы. При нагревании малиново-красного раствора K2FeO4 происходит разложение: 4K2FeO4 + 10H2O ® 4Fe(OH)3 + 3O2 + 8KOH
Оксид железа (VI) FeO3 и гидроксид железа (VI) – железная кислота H2FeO4 не получены в свободном виде, теоретически они должны проявлять кислотные свойства.
Таким образом, с повышением степени окисления железа:
1) усиливается кислотный характер оксидов и гидроксидов, ослабевает основной;
2) усиливаются окислительные свойства соединений и ослабевают восстановительные;
3) уменьшается устойчивость соединений.
Железо входит в побочную подгруппу VIII группы, особенность которой состоит в том. что она включает в себя 9 элементов – 3 триады. Наибольшее сходство этих элементов наблюдается не в вертикальных столбцах, а в горизонтальных триадах. Причем первая триада – семейство железа, куда входят Fе, Со, Ni, – наиболее сильно отличается от остальных элементов подгруппы (платиновых металлов). В ряду Fе – Со – Ni химическая активность понижается. В обычных условиях Со и Ni довольно устойчивы по отношению к кислороду. Элементы семейства железа образуют оксиды типа ЭО и Э2О3, которым соответствуют гидроксиды Э(ОН)2 и Э(ОН)3. Однако, если для железа наиболее устойчивыми являются соединения со степенью окисления +3, то для кобальта и никеля +2.
Подобным образом следует давать характеристику любому элементу с приведением соответствующих уравнений реакций.
Задания для самостоятельной работы
2.39. Оксид меди (II) растворяется:
1) в воде при обычной температуре 3) в разбавленных кислотах при нагревании
2) в воде при нагревании 4) в разбавленных растворах щелочей.
2.40. В схеме превращений: FeCl2 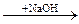 X1
X1 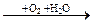 X2 веществом Х2 является 1) FeO 2) Fe(OH)3 3) FeCl2 4) FeCl3
X2 веществом Х2 является 1) FeO 2) Fe(OH)3 3) FeCl2 4) FeCl3
2.41. При прокаливании Cr(OH)3 образуется вода и:
1) оксид хрома (II) 2) оксид хрома (III) 3) оксид хрома (VI) 4) хром
2.42. Cульфат железа (II) растворили в воде и оставили в открытом сосуде. Составьте уравнения возможных процессов и опишите их внешние признаки.
2.43. С какими из перечисленных ниже веществ будет взаимодействовать раствор сульфата меди (II)?
1) раствор гидроксида калия 5) оксид углерода (IV)
2) железо 6) соляная кислота
3) раствор нитрата бария 7) раствор фосфата натрия.
4) оксид алюминия
(Запишите их номера в порядке увеличения и без пробелов между цифрами.)
2.11. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов
Общая характеристика неметаллов
Неметаллы располагаются, в основном, в конце малых и больших периодов. В пределах периода уменьшается радиус атома и возрастает число электронов на внешнем уровне, поэтому неметаллические свойства увеличиваются. В главных подгруппах у элементов наблюдается увеличение радиуса атома при постоянном числе электронов на внешнем уровне, поэтому неметаллические свойства уменьшаются. Самый активный неметалл – фтор.
Характерным свойством неметаллов является большее (по сравнению с металлами) число электронов на внешней электронной оболочке их атомов, следовательно, неметаллы являются окислителями. Например: Н2 + 2Nа 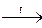 2NаН; Сl2 + 2КВr ® Вr2 + 2КСl.
2NаН; Сl2 + 2КВr ® Вr2 + 2КСl.
Особенно сильные окислительные свойства проявляют неметаллы, находящиеся во 2-м и 3-м периодах VI и VII групп. Самым сильным окислителем является фтор, для него не характерны восстановительные свойства. Все остальные неметаллы наряду с окислительными проявляют и восстановительные свойства. Например: S + Н2 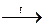 Н2S; S + О2 ® SО2.
Н2S; S + О2 ® SО2.
В соответствии с численными значениями относительных электроотрицательностей окислительные и восстановительные способности неметаллов изменяются в следующем порядке:
увеличение окислительных свойств
 Si, В, Н, Р, С, S, I, N, Сl, О, F
Si, В, Н, Р, С, S, I, N, Сl, О, F
 увеличение восстановительных свойств.
увеличение восстановительных свойств.
Характеризуя физические свойства неметаллов, следует отметить, что они, в основном, не имеют характерного металлического блеска и различно окрашены; в кристаллическом состоянии имеют различные структуры и прочность кристаллов, в большинстве случаев плохо проводят теплоту и электрический ток.
Семь неметаллических элементов существуют в виде двухатомных молекул: пять из них при н.у. представляют собой газы – водород, азот, кислород, фтор и хлор; бром – жидкость, а иод – кристаллическое вещество, способное возгоняться. Остальные неметаллы при н.у. образуют кристаллы с различной структурой (атомной, молекулярной). Молекулы благородных газов одноатомны.
Большинство неметаллов обладает высокой химической активностью. Взаимодействуя с металлами, типичные неметаллы образуют соединения с ионной связью (NаСl, СаО, К2S). В определенных условиях неметаллы реагируют между собой, образуя соединения с ковалентной связью – как полярные (Н2О, НСl, NН3), так и неполярные (СО2, СН4, С6Н6).
С водородом неметаллы образуют летучие соединения, например НF, Н2S, NН3, СН4. Водные растворы соединений галогенов, серы, селена и теллура с водородом являются кислотами, а раствор аммиака в воде проявляет основные свойства.
С кислородом неметаллы образуют кислотные (SО2, SО3, N2О3, N2О5) и безразличные (NО, СО) оксиды. Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет максимальную степень окисления. Например, азотная кислота НNО3 сильнее азотистой НNО2, а серная Н2SО4 сильнее сернистой Н2SО3.
Большинство неметаллов встречается в природе в виде соединений с другими элементами; лишь кислород, азот, сера, углерод и благородные газы существуют в виде простых веществ.
Галогены
Галогены – это естественная группа элементов-аналогов, расположенных в главной подгруппе VII группы периодической системы. К ним относятся фтор, хлор, бром, иод и астат.
На наружном энергетическом уровне атомы галогенов содержат по 7 электронов с конфигурацией s2р5, этим объясняется общность их свойств. Наличие одного неспаренного электрона на внешнем уровне указывает на то, что в невозбужденном состоянии галогены проявляют валентность I. Их атомы сильнее других элементов притягивают электроны, поэтому каждый галоген – самый сильный окислитель в своем периоде. Наиболее типичными для них являются соединения со степенью окисления –1. Это соединения галогенов с водородом и металлами. Например: НСl, КI, NаСl, НF и др.
Водные растворы водородных соединений галогенов являются кислотами: НF – фтороводородная (плавиковая), НСl – хлороводородная (соляная), НВr – бромоводородная, НI – иодоводородная кислоты.
Галогены в свободном виде состоят из двухатомных молекул и являются типичными неметаллическими веществами.
Окислительные свойства нейтральных атомов в подгруппе галогена уменьшаются от фтора к иоду (увеличивается радиус атома), а восстановительные усиливаются.
Реакционная способность галогенов падает в ряду фтор ® хлор ® бром ® иод. Поэтому предыдущий галоген вытесняет последующий из его соединений с водородом и металлами.
Закономерно изменяются физические свойства галогенов с ростом порядкового номера: фтор и хлор – газы, бром – жидкость, иод и астат – твердые вещества. Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек. Более значительные количества галогенов могут вызвать тяжелое отравление.
При рассмотрении химических свойств хлора следует учитывать, что он своеобразно реагирует с водородом. В темноте и при слабом освещении скорость реакции незначительна. При сильном ультрафиолетовом освещении реакция протекает мгновенно со взрывом.
Под влиянием света молекула хлора расщепляется на два атома: Сl2 = Сl× + Сl×.
Образовавшиеся атомы хлора далее вызывают цепь реакций замещения: атомарный хлор «атакует» молекулу водорода, что приводит к образованию хлороводорода и атомарного водорода, который в свою очередь реагирует с молекулой хлора и т. д.:
Н2 + Сl = НСl + Н×; Н× + Сl2 = НСl + Сl× и т.д.
Подобные реакции, в результате которых происходит цепь последовательных превращений, называют цепными реакциями.
Следует обратить внимание на то, что галогены помимо общих свойств имеют и различия.
Внешняя оболочка атомов фтора состоит только из 2s- и 2р-подуровней, у атомов же остальных галогенов внешние оболочки имеют вакантные орбитали d-подуровня. Следовательно, у них при переходе атомов в возбужденное состояние возможно увеличение числа неспаренных электронов до 7, что показано на схеме:
| Основное состояние | Возбужденные состояния |
     d – – – – – р d – – – – – р | d |
| d | |
| d |
Все галогены, кроме фтора, образуют соединения, в которых они обладают положительной степенью окисления (от +1 до +7). Наиболее важными из них являются кислородсодержащие кислоты галогенов. Такие соединения наиболее характерны для хлора, для которого известны четыре кислоты:
| Кислота | Степень окисления хлора | Название кислоты | Название аниона | Сила кислоты | Увеличение силы окислителя |
| НСlО | +1 | Хлорноватистая | Гипохлорит | Очень слабая | ¯ |
| НСlО2 | +3 | Хлористая | Хлорит | Слабая | |
| НСlО3 | +5 | Хлорноватая | Хлорат | Сильная | |
| НСlО4 | +7 | Хлорная | Перхлорат | Очень сильная |
При сравнении окислительной способности вещества всегда нужно учитывать реальные условия протекания процессов. Так, в обычных условиях (комнатная температура, действие света) окислительная активность уменьшается от хлорноватистой до хлорной кислоты, т.к. здесь решающее значение имеет не окислительная способность хлора в положительной степени окисления, а атомарный кислород, выделяющийся при распаде неустойчивых кислот, устойчивость которых на свету возрастает от хлорноватистой к хлорной кислоте. Если же сравнивать окислительную способность этих кислот в других условиях (в темноте, при более низких температурах), то окислительная способность возрастает от хлорноватистой к хлорной кислоте. Именно поэтому в последней графе таблицы окислительная активность кислот проиллюстрирована «обратимой» стрелкой.
Из солей кислородсодержащих кислот хлора широко известны бертолетова соль (хлорат калия) и хлорная (белильная) известь – хлорид-гипохлорит кальция Са(СlО)Сl.
Задания для самостоятельной работы
2.44. Конечным продуктом в цепочке превращений на основе соединений углерода
CO2 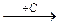 X1
X1 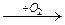 X2
X2 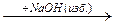 X3 является:
X3 является:
1) карбонат натрия 3) карбид натрия
2) гидрокарбонат натрия 4) ацетат натрия.
2.45. Какой из металлов не вытесняет водород из разбавленной серной кислоты:
1) железо 2) хром 3) медь 4) цинк
2.46. Соли кремниевой кислоты:
А) реагируют с уксусной кислотой Г) не подвергаются гидролизу
Б) подвергаются гидролизу Д) реагируют с гидроксидом натрия
В) реагируют с угольной кислотой Е) реагируют с водородом.
2.47. Оксид серы (IV) в химических реакциях
1) не проявляет окислительно-восстановительных свойств
2) является только окислителем
3) является только восстановителем
4) может быть как окислителем, так и восстановителем.
2.48. Приведите уравнения реакций, соответствующие схеме превращений:
Pb(NO3)2 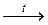 NO2 → N2O4 → HNO3 → NH4NO3
NO2 → N2O4 → HNO3 → NH4NO3  N2O.
N2O.
2.49. Установите соответствие между исходными веществами и формулой одного из продуктов реакции.
ИСХОДНЫЕ ВЕЩЕСТВА ФОРМУЛА ПРОДУКТА РЕАКЦИИ
1) Cu + H2SO4(конц.) → А) H2S
2) Mg + H2SO4(конц.) → Б) S
3) C + H2SO4(конц.)→ В) SO2
4) Ag + H2SO4(конц.)→ Г) H2SO3
2.50. Оксид углерода (IV) будет реагировать с:
А) HNO3 Б) Na2O В) С (t0) Г) NaCl Д) Ca(OH)2 Е) P2O5
2.12. Характерные химические свойства неорганических веществ различных классов: оксидов (основных, амфотерных, кислотных), оснований, амфотерных гидроксидов, кислот, солей
Способы получения и свойства неорганических веществ
 2014-02-05
2014-02-05 1866
1866
