БЕЛКИ
Структура и молекулярная масса РНК-геномов вирусов животных
Таблица 4.
| Семейство | Структура | Информационные функции | Молекулярная масса |
| Пикорнавирусы | Линейная однонитчатая | «Плюс»-нитевая | 2,7·106 |
| Тогавирусы | Линейная однонитчатая | «Плюс»-нитевая | 4·106 |
| Парамиксовирусы | Линейная однонитчатая | «Минус»-нитевая | 5·106-7,5·106 |
| Рабдовирусы | Линейная однонитчатая | «Минус»-нитевая | 3,8·106-4,5·106 |
| Ортомиксовирусы | Фрагментированная (8 уникальных фрагментов) | «Минус»-нитевая | От 0,2·106 до 1·106, всего 5·106 |
| Буньявирусы | Фрагментированная однонитчатая кольцевая (3 уникальных фрагмента L, M, S) | «Минус»-нитевая | L 3· 106-5·106 M 1·106-2·106 S 0,4·106-0,8·106 |
| Аренавирусы | Фрагментированная однонитчатая кольцевая и линейная формы; 2 вирус-специфических фрагмента L и S | «Амбисенс»» | L 2,1·106-3,2·106 S 1,1·106-1,6·106 |
| Реовирусы | Фрагментированная двунитчатая (10—12 уникальных фрагментов) | ДиплоРНК-вирусы | 0,2·106-3·106 |
| Ретровирусы | Однонитчатая, 2 идентичные молекулы | «Плюс»-нитевая, в составе внутриклеточной формы | По 3·106, всего 6·106-7·106 |
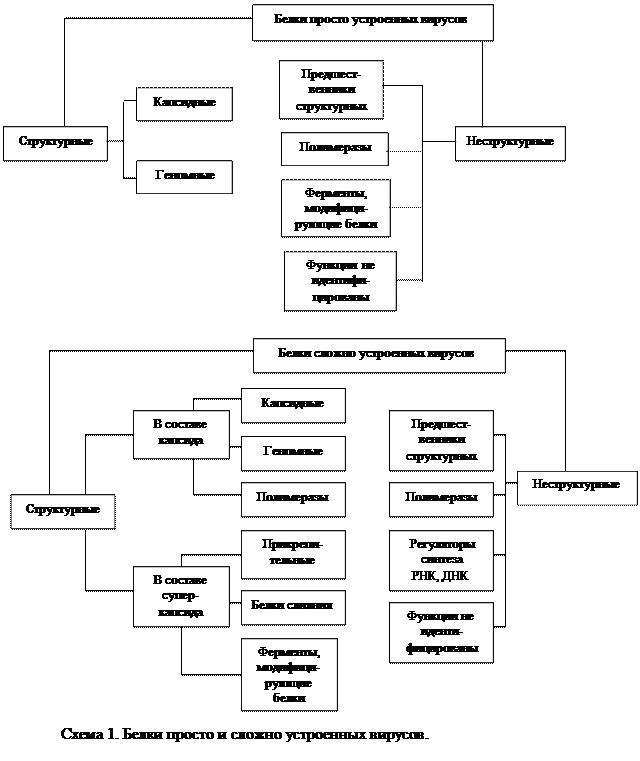
В зараженной клетке вирусный геном кодирует синтез двух групп белков: 1) структурных, которые входят в состав вирусных частиц потомства, и 2) неструктурных, которые обслуживают процесс внутриклеточной репродукции вируса на разных его этапах, но в состав вирусных частиц не входят.
СТРУКТУРНЫЕ БЕЛКИ
Количество структурных белков в составе вирусной частицы варьирует в широких пределах в зависимости от сложности организации вириона. Наиболее просто организованный вирус табачной мозаики содержит всего один небольшой белок с молекулярной массой 17-18·103, некоторые фаги содержат 2-3 белка, просто организованные вирусы животных — 3-4 белка. Сложно устроенные вирусы, такие как вирусы оспы, содержат более 30 структурных белков.
Структурные белки делятся на 2 группы:
1) капсидные белки, образующие капсид, т. е. футляр для нуклеиновой кислоты вируса (от лат. capsa — вместилище), и входящие в состав капсида геномные белки и ферменты;
2) суперкапсидные белки, входящие в состав суперкапсида, т. е. наружной вирусной оболочки.
Поскольку суперкапсид называют также «пеплос» (от греч. peplos — покров, мантия), эти белки называют пепломерами.
Просто организованные вирусы, представляющие собой нуклеокапсид, содержат только капсидные белки. Сложно организованные вирусы содержат капсидные и суперкапсидные белки.
Капсидные белки. Первоначальное представление о том, что капсидные белки являются всего лишь инертной оболочкой для вирусной нуклеиновой кислоты, сложилось на основании изучения наиболее просто организованного вируса табачной мозаики, частица которого состоит из одной молекулы РНК и одного типа белка, образующего чехол для РНК.
Однако такое представление неправильно. Хотя основной функцией капсидных белков является функция защиты вирусного генома от неблагоприятных воздействий внешней среды, у многих вирусов в составе капсида есть белки и с другими функциями. Поэтому термин «капсид» далеко выходит за пределы представления о нем как о футляре или чехле для вирусной нуклеиновой кислоты.
В составе капсида некоторых вирусов (пикорнавирусы, паповавирусы, аденовирусы) содержатся белки, ковалентно связанные с вирусным геномом (геномные белки). Эти белки являются терминальными, т. е. соединенными с концом вирусной нуклеиновой кислоты. Функции их неразрывно связаны с функциями генома и их регуляцией»
У ряда сложно организованных вирусов в составе капсида имеются ферменты, осуществляющие транскрипцию и репликацию вирусного генома — РНК и ДНК (РНК и ДНК-полимеразы), а также ферменты, модифицирующие концы иРНК. Если ферменты и геномные белки представлены единичными молекулами, то капсидные белки представлены множественными молекулами. Эти белки и формируют капсидную оболочку, в которую у сложно организованных вирусов вставлены молекулы белков с другими функциями.
Основным принципом строения капсидной оболочки вирусов является принцип субъединичности, т. е. построение капсидной оболочки из субъединиц — капсомеров, образованных идентичными полипептидными цепями. Правильно построенные белковые субъединицы — капсомеры возникают благодаря способности вирусных капсидных белков к самосборке. Самосборка объясняется тем, что упорядоченная структура — капсид имеет наименьшую свободную энергию по сравнению с неупорядоченными белковыми молекулами. Сборка капсидной оболочки из субъединиц запрограммирована в первичной структуре белка и происходит самопроизвольно или при взаимодействии с нуклеиновой кислотой.
Принцип субъединичности в строении вирусного капсида является универсальным свойством капсидных белков и имеет огромное значение для вирусов. Благодаря этому свойству достигается огромная экономия генетического материала. Если бы капсидная оболочка была построена из разных белков, то на кодирование ее потребовалась бы основная часть генетической информации, заложенной в вирусном геноме. В действительности на кодирование, например, одной полипептидной цепи вируса табачной мозаики, расходуется менее 10 % генома. Далее, в механизме самосборки заложена возможность контроля за полноценностью вирусных полипептидов: дефектные и чужеродные полипептидные цепи при таком способе сборки вирионов будут автоматически отбрасываться.
Описанная способность к самосборке в пробирке и в зараженной клетке характерна только для простых вирусов. Сборка сложно организованных вирусов является гораздо более сложным многоступенчатым процессом, хотя отдельные ее этапы, например формирование капсидов и нуклеокапсидов, также основаны на самосборке.
Суперкапсидные белки. Гликопротеиды. Суперкапсидные белки, или пепломеры, располагаются в липопротеидной оболочке (суперкапсиде или пеплосе) сложно устроенных вирусов. Они либо пронизывают насквозь липидный бислой как, например, гликопротеиды альфа-вирусов (вируса леса Семлики), либо не доходят до внутренней поверхности. Эти белки являются типичными внутримембранными белками и имеют много общего с клеточными мембранными белками. Как и последние, суперкапсидные белки обычно гликозилированы. Углеводные цепочки прикреплены к молекуле полипептида в определенных участках. Гликозилирование осуществляют клеточные ферменты, поэтому один и тот же вирус, продуцируемый разными видами клеток, может иметь разные углеводные остатки: может варьировать как состав углеводов, так и длина углеводной цепочки и место прикрепления ее к полипептидному ocтoвy.
У большинства вирусов гликопротеиды формируют «шипы» на поверхности вирусной частицы, длина которых достигает 7-10 нм. Шипы представляют собой морфологические субъединицы, построенные из нескольких молекул одного и того же белка. Вирусы гриппа имеют два типа шипов, построенных соответственно из гемаглютинина и нейраминидазы. Парамиксовирусы также имеют два типа шипов, построенных соответственно из двух гликопротеидов (HN и F), рабдовирусы имеют только один гликопротеид и, соответственно, один тип шипов, а альфа-вирусы имеют два или три гликопротеида, формирующих один тип шипов.
Гликопротеиды являются амфипатическими молекулами: они состоят из наружной, гидрофильной части, которая содержит на конце аминогруппу (N-конец), и погруженной в липидный бислой, гидрофобной части, которая содержит на погруженном конце гидроксильную группу
Основной функцией гликопротеидов является взаимодействие со специфическими рецепторами клеточной поверхности. Благодаря этим белкам осуществляется распознавание специфических клеточных рецепторов и прикрепление к ним вирусной частицы, т.е. адсорбция вируса на клетке. Поэтому гликопротеиды, выполняющие эту функцию, называют вирусными прикрепительными белками.
Другой функцией гликопротеидов является участие в слиянии вирусной и клеточной мембран, т.е. в событии, ведущем к проникновению вирусных частиц в клетку. Вирусные белки слияния ответственны за такие процессы, как гемолиз и слияние плазматических мембран соседних клеток, приводящие к образованию гигантских клеток, синцитиев и симпластов.
«Адресная функция» вирусных белков. Вирусы вызывают инфекционный процесс у относительно небольшого круга хозяев. Вирус должен «узнать» чувствительную клетку, которая сможет обеспечить продукцию полноценного вирусного потомства. Если бы вирус проникал в любую клетку, которая встретилась на его пути, это привело бы к исчезновению вирусов в результате деструкции «родительской» вирусной частицы и отсутствия вирусного потомства. В процессе эволюции у вирусов вырабатывалась так называемая адресная функция, т.е. поиск чувствительного хозяина среди бесконечного числа нечувствительных клеток. Эта функция реализуется путем наличия специальных белков на поверхности вирусной частицы, которые узнают специфический рецептор на поверхности чувствительной клетки.
Вирусные прикрепительные белки. Прикрепительные белки могут находиться в составе уникальных органелл, таких как структуры отростка у Т-бактериофагов или фибры у аденовирусов, которые хорошо видны в электронном микроскопе; могут формировать морфологически менее выраженные, но не менее уникальные аранжировки белковых субъединиц на поверхности вирусных мембран, как, например, шипы у оболочечных вирусов, «корону» у коронавирусов.
Просто организованные вирусы животных содержат прикрепительные белки в составе капсида. У сложно организованных вирусов эти белки входят в состав суперкапсида и представлены множественными молекулами.
Неструктурные белки изучены гораздо хуже, чем структурные, поскольку их выделяют не из очищенных препаратов вирусов, а из зараженных клеток, и возникают трудности в их идентификации и очистке от клеточных белков.
К неструктурным белкам относятся:
1) предшественники вирусных белков, которые отличаются от других неструктурных белков нестабильностью в зараженной клетке в результате быстрого нарезания на структурные белки;
2) ферменты синтеза РНК и ДНК (РНК и ДНК-полимеразы), обеспечивающие транскрипцию и репликацию вирусного генома;
3) белки-регуляторы;
4) ферменты, модифицирующие вирусные белки, например протеиназы и протеинкиназы.
Однако многие неструктурные белки при ряде вирусных инфекций еще не идентифицированы и функции их не определены.
Типы структурных и неструктурных белков просто и сложно устроенных вирусов и их функции показаны на схеме 1.
 2014-02-05
2014-02-05 6484
6484








