Аналитические методы расчета физических свойств
Для определения многих физических свойств природных газов используют уравнение состояния - аналитическую зависимость между параметрами, описывающими изменение
простого или сложного вещества (давление, объём и температура).
Клапейрон и Менделеев предложили следующее уравнение состояния идеальных газов:
 (14)
(14)
где р - абсолютное давление. Па;
V - объём, м3;
G - масса вещества, кг;
Т - абсолютная температура, К;
R - удельная газовая постоянная, Дж/(кг К).
Идеальным называется газ, собственный объём молекул, которого пренебрежимо мал по сравнению с объёмом, занимаемым газом, и когда отсутствует взаимодействие между молекулами.
С термодинамической точки зрения идеальным называется газ, для которого справедливо равенство
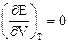 (15)
(15)
где Е - внутренняя энергия парообразования, Дж/моль или
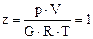 (16 )
(16 )
где z - коэффициент отклонения реального газа от закона идеального.
Экспериментальная проверка уравнения (14), проведенная многими исследователями, показала, что изменение свойств реальных газов при высоких давлениях нельзя описать зависимостью (16).
Голландский физик Ван-дер-Ваальс в 1879 г. предложил учесть собственный объём молекул газа и силы их взаимного притяжения посредством введения дополнительных членов в уравнение Клапейрона - Менделеева:
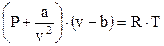 (17)
(17)
где v - V/G - удельный объем газа, м3/кг;
а/v2 - константа сцепления молекул. Па;
b - поправка на собственный объём молекул, м3.
В уравнении (17) слагаемое а/v2, выражает внутреннее давление, которое является как бы равнодействующей сил притяжения всех молекул в объёме V. Оно прибавляется к внешнему давлению. Это уравнение приближенное.
В соотношениях для критического состояния вещества
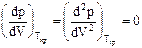 (18)
(18)
коэффициенты a и b выражаются через критическое давление ркр и критическую температуру Ткр следующим образом:
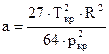 ;
; 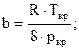 (19)
(19)
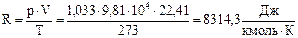
Ван-дер-Ваальс нашел, что поправка b на собственный объём молекул, имеющих шарообразную форму, равна учетверённому объёму молекул.
Уравнение (17) приближенное. Коэффициенты а и b в действительности являются сложными функциями объёма, температуры, формы молекул газа.
Критическая температура чистого вещества - это максимальная температура, при которой жидкая и паровая фазы могут сосуществовать в равновесии, или та температура, при которой средняя молекулярная кинетическая энергия становится равной потенциальной энергии притяжения молекул. При более высокой температуре существование жидкой фазы невозможно.
Давление паров вещества при критической температуре называется критическим давлением, а объём вещества, отнесенный к одному молю или другой единице массы вещества, называется критическим удельным объёмом. Критической принято называть такую температуру, выше которой газ под действием давления любого значения не может быть обращен в жидкость.
На рис. 1. приведена зависимость давления (упругости насыщенных паров) чистых веществ от температуры. Эта зависимость более точно описывает изменение свойств реальных газов при давлениях до 10 МПа и температурах от 283 до 293 К, но она не может численно описывать изменение, свойств многокомпонентных смесей месторождений природных газов.
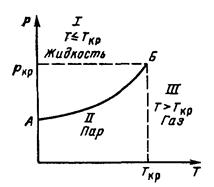
Рисунок 1. Зависимость давления (упругости насыщенных паров) чистых веществ от температуры
Давление, необходимое для сжижения газа при критической температуре, называется критическим. Кроме критического давления и критической температуры вводится понятие критического объёма, равного объёму одного моля газа при критических давлении и температуре. Для природных газов, представляющих собой смесь отдельных компонентов, значения Ркр и Ткр определяются как среднекритические (псевдокритические).
Средние критические давление и температуру смеси можно определить по формулам:
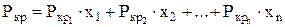 (20)
(20)
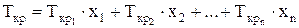
где х1, х2…хn - объёмные доли компонентов, входящих в состав газа;
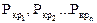 - критические давления компонентов;
- критические давления компонентов;
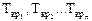 - критические температуры компонентов.
- критические температуры компонентов.
Следует отметить, что коэффициент сверхсжимаемости природной углеводородной смеси Zсм можно определить по графической зависимости представленной на рисунке 1.2.
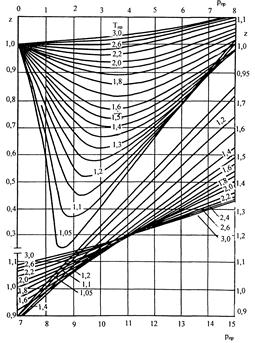
Рис. 1.2. Значение коэффициента сверхсжимаемости z по данным Стэндинга и Катца
Если известна относительная плотность газа 
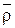 , то средние критические давление и температуру природного газа можно определить по графикам.
, то средние критические давление и температуру природного газа можно определить по графикам. При содержании в природном газе N2, СО2 или H2 S в значения Ркр и Тк р вводятся соответствующие поправки. Когда содержание N2, CO2 или Н2 S превышает 15% об., вместо графиков для определения Ркр и Тк р следует пользоваться формулой (1.20).
При содержании в природном газе N2, СО2 или H2 S в значения Ркр и Тк р вводятся соответствующие поправки. Когда содержание N2, CO2 или Н2 S превышает 15% об., вместо графиков для определения Ркр и Тк р следует пользоваться формулой (1.20).
Для приближенных расчётов при изменении 
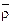 , от 0,5 до 0,9 значения Ркр и Тк р можно определить по формулам:
, от 0,5 до 0,9 значения Ркр и Тк р можно определить по формулам:
 , МПа (21)
, МПа (21)
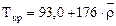 , К
, К
Часто в расчётах, например, при определении вязкости и коэффициента сверхсжимаемости газа, пользуются так называемыми приведенными давлениями и температурами. Приведенными параметрами индивидуальных компонентов называют безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (давление, абсолютная температура, объём, плотность, коэффициент отклонения) больше или меньше критических:
Приведенным давлением Рпр называется отношение давления газа Р к его критическому давлению Ркр
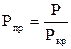 (22)
(22)
Приведенной температурой газа Тпр называется отношение абсолютной температуры газа Т к его критическому значению:
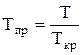 , (23)
, (23)
Дальнейший прогресс науки и техники потребовал разработки более точного уравнения состояния природных газов, способного правильно описывать изменение их свойств при давлениях до 100 МПа и температурах до 573 К в процессах добычи газа и при давлениях до 20 МПа и низких температурах до 223 - 93 К (от минус 50 до минус180°С) в процессах переработки природных газов.
В решении этой проблемы выявились два направления:
1) введение поправочного коэффициента z в уравнение состояния идеального газа (1.17), учитывающего отклонение реального газа от идеального, т. е. pV==zRT
2) дополнение уравнения состояния идеального газа большим числом констант.
 2014-02-05
2014-02-05 1162
1162
