Реальные природные газы - физические смеси большого числа углеводородных и неуглеводородных компонентов, простых и сложных газов. Молекулы простых газов (метан, гелий, аргон, криптон, ксенон и др.) имеют сферическую форму. Молекулы сложных газов и жидкостей имеют более сложную форму. Для простых газов силы притяжения, действующие вдоль линии, соединяющей центры сферических молекул, пропорциональны шестой степени расстояния. Для сложных газов и жидкостей силы притяжения (или отталкивания) между различными группами молекулярных пар не могут быть представлены лишь одной силой притяжения между центрами молекул. Для учёта других, нецентричных сил вводится ацентрический фактор ω - третий после приведенного давления и температуры параметр, оценивающий меру отклонения коэффициента сверхсжимаемости природных газов от его значения, определяемого с помощью классической двухпараметрической теоремы соответственных состояний, т. е. по Рпр и Тпр:
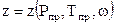 (24)
(24)
или
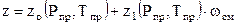 (25)
(25)
где zо (Рпр, Тпр) - коэффициент сверхсжимаемости простого газа, определяемый но данным Рпр и Тпр; z1(Рпр, Тпр) - поправка к обобщенному коэффициенту сверхсжимаемости сложных газов и жидкостей, являющаяся функцией приведенного давления и температуры; (ωсм -  ацентрический фактор смеси газов (для простых газов (ωсм = 0).
ацентрический фактор смеси газов (для простых газов (ωсм = 0).
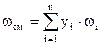 (26)
(26)
где ωi - ацентрический фактор i-го компонента в смеси, который можно определить по формуле Эдмистера:
где 540 < Ткр < 775 К, 372 < ТКИП < 625 К.
 2014-02-05
2014-02-05 1042
1042








