Использование в вирусологии куриных эмбрионов. Заражение куриных эмбрионов
Цель занятия: ознакомить студентов с методами заражения куриных эмбрионов для культивирования вирусов.
Оборудование и материалы: куриные эмбрионы 9-12 дневного возраста инкубации, овоскоп, спиртовые тампоны, подставки для эмбрионов, пинцеты, ножницы, лейкопластырь, иглы, шприцы, простые карандаши, пробойники, иголочки, таблицы, схемы, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Объяснение преподавателя.
Существенно влияет на размножение вирусов в эмбрионах метод заражения. Перед заражением инкубированные яйца просвечивают, погибшие отделяют. На скорлупе яиц с живыми эмбрионами, которые различают по красному цвету кровеносных сосудов и движению эмбриона, карандашом отмечают место заражения.
Заражают эмбрионы в стерильном боксе, имеющем рабочий стол, два табурета, подводку газа, водопровод и вакуум. Заражение в амниотическую полость проводят в затемненной комнате. Рабочее место должно быть хорошо освещено. Перед работой стол дезинфицируют. Для дезинфекции поверхности яиц подготавливают антисептический раствор (70%-ный спирт, 2%-ный раствор йода) и обернутую ватой деревянную палочку, согнутый зубной зонд или бормашину для просверливания яичной скорлупы. Яйца заражают при помощи стерильных шприца для туберкулинизации и специальных игл. Место заражения на яйце заливают парафином. Для этого готовят парафиновые палочки: в пробирку, заполненную расплавленным парафином, вводят стеклянную палочку, следя за тем, чтобы она находилась в центре пробирки до остывания парафина.
Когда парафиновая палочка понадобится, стенки пробирки нагревают на горелке и за стеклянную палочку вытягивают парафин из пробирки. Подержав палочку над пламенем, расплавляют необходимое для закрытия отверстия в яйце количество парафина. Этот способ очень чист, и при нем не образуются пары парафина.
Кроме того, на рабочем столе в боксе размещают стакан со стерильными ватными тампонами, стакан с 3 % раствором едкого натра для использованных инструментов и сосуд с раствором хлорамина для использованных стеклянных предметов. В случае надобности можно приготовить подставку для яиц, небольшую эмалированную чашку и стерильные питательные среды. Подготовленный таким образом рабочий стол в течение 1–2 ч подвергают УФ-облучению.
Учитывая патогенность исследуемых вирусов, работы ведут в маске, резиновых перчатках и защитных очках.
Существует шесть методов заражения эмбрионов. Наиболее часто используют заражение в аллантоисную полость и на хорионаллантоисную оболочку, реже – в амниотическую полость и в желточный мешочек и совсем редко – в тело зародыша и в кровеносные сосуды ХАО. Выбор метода определяется тропизмом вируса, а также целью заражения. При любом методе заражения вводят 0,1–0,2 мл инфекционного материала.
Заражение в аллантоисную полость.
При заражении этим методом хорошо размножаются вирусы гриппа, ньюкаслской болезни, ринопневмонии лошадей, везикулярного стоматита и др. Существует несколько вариантов метода.
Первый вариант. Эмбрион фиксируют вертикально тупым концом вверх. В скорлупе на стороне зародыша, а иногда с противоположной зародышу стороны на 5–6 мм выше границы воздушной камеры делают отверстие диаметром около 1 мм. Иглу вводят параллельно продольной оси на глубину 10–12 мм (рис. 16). После инъекции вируссодержащего материала иглу извлекают, а отверстие в скорлупе закрывают каплей расплавленного стерильного парафина.
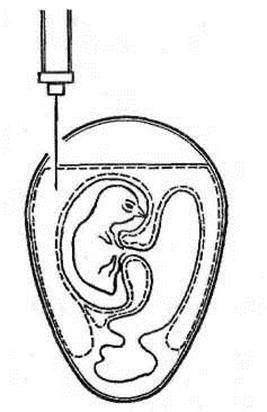
Рисунок 16. Заражение в аллантоисную полость (первый вариант) (по Николау)
Второй вариант. Сделанное в скорлупе над воздушной камерой отверстие используют лишь для выхода части воздуха. Отверстие же для самого заражения делают на участке бессосудистой зоны хорионаллантоисной оболочки (ХАО) со стороны зародыша. Иглу вводят на глубину не более 2–3 мм. Инъецируют инфицирующую жидкость в объеме 0,1–0,2 мл и закрывают отверстие парафином (см. рис. 17).
Заражение на хорионаллантоисную оболочку.
Этот метод заражения куриных эмбрионов чаще используют для культивирования эпителиотропных и пантропных вирусов оспы, инфекционного ларинготрахеита птиц, чумы плотоядных, болезни Ауески, катаральной лихорадки овец и др.
Такое заражение может быть выполнено через естественную или искусственную воздушную камеру.
Для заражения через естественную воздушную камеру эмбрион помещают в штатив вертикально тупым концом вверх и в скорлупе против центра воздушной камеры вырезают круглое окно диаметром 15–20 мм. Через это окно пинцетом снимают подскорлупную оболочку. На обнажившийся участок ХАО наносят 0,2 мм вируссодержащей суспензии (рис. 18), отверстие закрывают лейкопластырем или реже покровным стеклом, укрепив его расплавленным парафином.
Заражение через искусственную воздушную камеру применяют чаще первого, так как оно обеспечивает контакт вируссодержащего материала с большей поверхностью ХАО и, следовательно, ведет к образованию большего количества вируса.
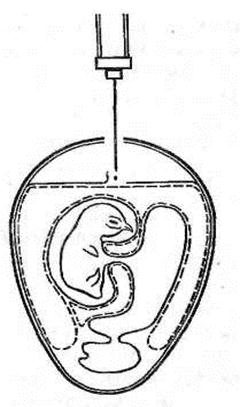
Рисунок 17. Заражение куриного эмбриона в аллантоисную полость (второй вариант) (по Николау)
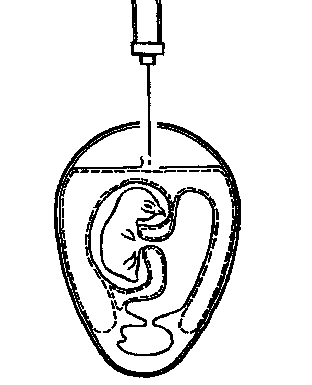
Рисунок 18. Заражение на ХАО через естественную воздушную камеру (по Николау и др.)
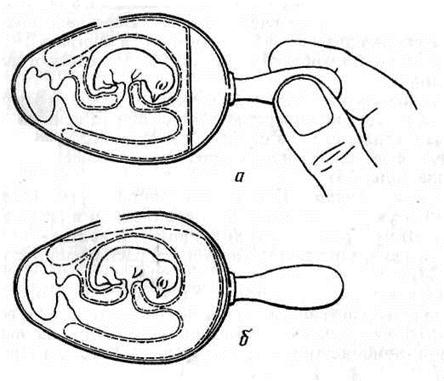
Рисунок 19. Заражение куриного эмбриона на ХАО через искусственную воздушную камеру (по Николау и др.)
Для заражения эмбриона этим методом его помещают в штатив горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое над центром воздушной камеры (предназначено для отсасывания из нее воздуха), а другое диаметром 0,2–0,5 см сбоку, со стороны зародыша. Сложность метода в том, что, делая второе отверстие, необходимо осторожно снять вначале кусочек скорлупы, затем скользящим движением, не повреждая ХАО, сдвинуть подскорлупную оболочку в сторону так, чтобы через образовавшийся дефект мог пройти воздух. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры (рис. 19, а).В результате через боковое отверстие наружный воздух устремляется внутрь, образуя искусственную воздушную камеру, дном которой является ХАО (рис. 19, б).
Через боковое отверстие на поверхность ХАО наносят инфекционную жидкость и отверстие закрывают кусочком лейкопластыря. Закрывать первое отверстие нет необходимости, так как внутренний листок подскорлупной оболочки при этом методе заражения не нарушается и продолжает выполнять роль барьера для микрофлоры окружающей среды.
Дальнейшую инкубацию эмбрионов, зараженных этим методом, проводят в горизонтальном положении боковым отверстием вверх.
Заражение в желточный мешок.
Большей частью им пользуются для размножения хламидий, а также вирусов болезни Марека, ринопневмонии лошадей, катаральной лихорадки овец и др. Заражают эмбрионы 5–7-дневного, а иногда и 2–3-дневного возраста (вирус лихорадки долины РИФ). Используют два варианта заражения.
Первый вариант. Эмбрионы помещают в штатив в вертикальном положении. Делают отверстие в скорлупе над центром воздушной камеры и вводят иглу на глубину 3,5–4 см под углом 45° к вертикальной оси в направлении, противоположном месту нахождения зародыша (рис. 20).
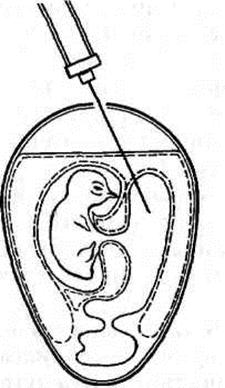
Рисунок 20. Заражение куриного эмбриона в желточный мешок (по Николау и др.)
Второй вариант. Иногда аналогичный путь заражения осуществляется на горизонтально укрепленном в штативе эмбрионе; при этом зародыш находится внизу, а желток над ним. Отверстие в скорлупе закрывают каплей расплавленного парафина.
Заражение в амниотическую полость.
Для этой цели используют эмбрионы 6 - 10-дневного возраста. Метод используется при культивировании вирусов гриппа, ньюкаслской болезни, ринопневмонии лошадей и др. Есть два способа заражения.
Закрытый способ. Заражение проводят в затемненном боксе. Яйцо помещают на овоскопе в горизонтальном положении зародышем вверх. Через отверстие в скорлупе над воздушной камерой вводят иглу с затупленным концом по направлению к зародышу. Доказательством того, что игла проникла в амнион, служит движение тела зародыша в направлении передвижения.
Открытый способ. Скорлупу над воздушной камерой срезают так, чтобы образовалось окно диаметром 1,5–2,5 см. Через него пинцетом под контролем глаза снимают подскорлупную оболочку. Затем анатомический (14 см) пинцет с сомкнутыми браншами ведут, продавливая хорионаллантоисную оболочку по направлению к зародышу. Когда пинцет достигнет его, бранши размыкают, захватывают амниотическую оболочку вместе с ХАО и подтягивают к окну. Удерживая левой рукой пинцет с фиксированной в нем оболочкой амниона, вводят вируссодержащий материал (рис. 21). Далее все оболочки опускают, окно закрывают лейкопластырем и эмбрион инкубируют в вертикальном положении.
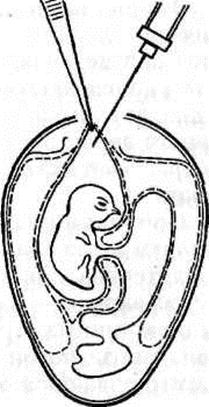
Рисунок 21. Заражение куриного эмбриона в амнион открытым способом (по Николау и др.)
Заражение в кровеносные сосуды ХАО.
При овоскопировании 11– 13-дневных эмбрионов отмечают крупный кровеносный сосуд. По его ходу удаляют участок скорлупы, наносят 1–2 капли спирта, что делает на некоторое время подскорлупную оболочку прозрачной. Под контролем глаза на овоскопе иглу вводят в сосуд, что подтверждается его подвижностью при небольших боковых движениях иглы. Обнаженный участок подскорлупной оболочки закрывают кусочком лейкопластыря.
Можно материал в сосуды ввести и несколько отличающимся способом: срезают скорлупу над воздушной камерой, подскорлупную оболочку смачивают спиртом и в ставшие видными сосуды ХАО вводят материал. Отверстие закрывают кусочком стерильного лейкопластыря.
Описанные технические приемы экспериментального заражения куриных эмбрионов не единственные, а имеют различные варианты.
Заражение в тело зародыша.
Для заражения используют эмбрионы 7–12-дневного возраста. Известно два варианта метода.
Первый вариант. Заражают так же, как в амнион закрытым способом, с той лишь разницей, что берут острую иглу и на овоскопе показателем попадания иглы в тело считают подчинение зародыша движениям иглы.
Второй вариант. Заражают так же, как в амнион открытым способом: через окно в скорлупе подтягивают пинцетом тело зародыша. Материал вводят в головной мозг или определенные участки тела. При таких методах заражения бывает значительный процент неспецифической гибели эмбрионов.
Накопление вируса в курином эмбрионе
Перед дальнейшей инкубацией на скорлупе зараженных любым методом куриных эмбрионов простым (графитным) карандашом пишут, чем заражен эмбрион и когда, а если нужно, то и другие сведения. Зараженные куриные эмбрионы помещают в термостат для дальнейшей инкубации, в процессе которой происходят репродукция внесенных вирусов и их накопление в соответствующих структурах. Температура инкубации эмбрионов варьирует от 33 до 38 °С в зависимости от свойств вируса, которым проведено заражение. За эмбрионами ведут постоянное наблюдение, просматривают на овоскопе, отбирая павшие.
Гибель эмбрионов в первые 24 ч после заражения чаще всего обусловлена размножением грибов, бактериальной микрофлоры, внесенных в эмбрион вместе с инокулятом, или травмированием при заражении. Эта гибель считается неспецифической. В более поздние сроки эмбрионы гибнут в результате, как правило, размножения в эмбрионах вируса. Обнаружив погибшие эмбрионы, их сразу же переносят в холодильник с температурой 4 °С. Такие условия, с одной стороны, способствуют сохранению активности накопившегося в эмбрионе вируса, с другой – уплотнению тканей и запустению сосудов, что значительно облегчает последующее вскрытие.
Эмбрионы инкубируют до момента максимального накопления вируса. Для каждого вируса и даже штамма этот срок является определенным и варьирует в пределах от 2 до 7-8 сут. Так, для вируса ньюкаслской болезни штамма Н он составляет 2-3 дня, для того же вируса штамма В,– 5 дней, для вируса инфекционного ларинготрахеита птиц – 5 дней и т. д. Затем все эмбрионы умерщвляют охлаждением при 4 °С в течение не менее 3–4 ч и вскрывают.
Деэмбринированные яйца.
В основе метода лежит удаление эмбриона из яйца в период, когда к его скорлупе изнутри полностью прилегает хорионаллантоисная оболочка. Если внутрь такого яйца добавить питательную среду, то образуется своеобразная культура ткани, в которой может размножаться вирус. Метод обладает рядом преимуществ: он позволяет получить более чистый вирус, чем в аллантоисно-амниотической жидкости, что важно для снижения аллергизирующих свойств вакцин, приготовленных из этого материала; отсутствие желточного мешка и, следовательно, содержащихся в нем специфических антител позволяет лучше размножаться некоторым вирусам. В некоторых случаях этот метод дает хорошие результаты в диагностических работах, так как при нем можно вводить большие количества исследуемого материала, что увеличивает возможность выделения вируса.
Метод предложил Бернкопф еще в 1949 г., но из-за трудностей применения широко не используется. Трудности эти связаны со свойством хорионаллантоисной оболочки в процессе инкубации отделяться от скорлупы, что снижает ценность культуры и затрудняет манипуляции получения вируса и замены питательной среды.
Е. Гройель (1963) ввел ряд модификаций, которые позволили устранить эти трудности. Он предложил использовать 15-дневные и даже более старые яйца, которые в процессе инкубации следует часто переворачивать для равномерного развития оболочки на скорлупе яйца. При просвечивании обозначают границы воздушной камеры. Скорлупу отпиливают на 0,5 см выше этой линии, на край скорлупной оболочки наливают расплавленный парафин (56-58 С°), который застывая, фиксирует край яйца. Затем вырезают круглое отверстие в оболочке над зародышем, оставляя вокруг узкий ободок. Следующий этап – осторожное удаление зародыша из яйца. При этом яйцо следует удерживать в горизонтальном положении и медленно поворачивать. Таким путем находят сосуды, связывающие эмбрион с ХАО, и перерезают их ножницами. Если яйцо держать вертикально, то зародыш своей массой оттягивает оболочку, отрывая ее обычно в области острого конца яйца. Попадание даже небольшого количества жидкости между ХАО и скорлупой вызывает полную отслойку оболочки в течение 1–2 дней.
После удаления зародыша оболочку, выстилающую яйцо, несколько раз промывают физиологическим раствором, охлажденным до 4–0°С, до тех пор, пока жидкость не станет прозрачной. Затем в полость яйца вводят 20 мл питательной среды, подогретой до 37 °С, и яйцо закрывают стерильным резиновым колпачком, предварительно погрузив его в парафин. Трубка с резиновой пробкой, вмонтированная в яйцо, обеспечивает как взятие, так и введение жидкости без опасности бактериального заражения. Такой биологический объект сохраняет жизнеспособность в течение нескольких дней.
По методике Йошино и других, полость деэмбринированных яиц заполняют раствором агара в растворе Хенкса. Заражают деэмбринированные яйца через трубку в колпачке.
Контрольные вопросы:
1. Строение куриного эмбриона.
2. Для чего используют куриные эмбрионы в вирусологии?
3. Каково строение развивающегося куриного эмбриона?
 2014-02-05
2014-02-05 21555
21555








