Примеры тестовых заданий по теме 6
Контрольные вопросы к теме 6
1. Укажите основные области использования серной кислоты и олеума.
2. Почему в настоящее время в качестве серусодержащего сырья иcпользуется преимущественно сера, а не колчедан?
3. Чем отличаются технологические схемы производства серной кислоты из серы и из колчедана? Дайте объяснение.
4. С какой целью печной газ перед контактированием разбавляют воздухом?
5. В чем заключается специальная очистка печного газа, полученного обжигом колчедана?
6. Какие катализаторы используются в производстве серной кислоты? Приведите состав контактных масс БАВ и СВД.
№1
Последовательность стадий производства серной кислоты контактным методом
- получение обжигового газа
- подготовка газа к контактированию
- контактирование
- абсорбция серного ангидрида
№2
Серную кислоту в промышленном масштабе производят из:
- мрамора;
- апатита;
- газовой серы;
- железного колчедана;
- селитры.
Ключевое значение технологии связанного атмосферного азота в производстве продовольствия. Альтернативные варианты перспективы решения связывания атмосферного азота. Структура современного производства аммиака из природного газа. Многоступенчатая схема приготовления и очистки азотоводородной смеси. Особенности циркуляционной схемы синтеза аммиака; физико-химические основы выбора оптимальных условий синтеза; катализаторы в производстве аммиака.
Современная технологическая схема производства азотной кислоты. Технологические решения, способствующие высокому выходу продукта. Физико-химические основы и аппаратурное оформление процессов селективного окисления аммиака, оксидов азота и их абсорбции.
Газообразный азот - одно из самых устойчивых химических соединений (веществ). Энергия связи в молекуле азота составляет 945кДж/моль. Как результат: азот элементарный нереакционноспособен. В атмосфере азот находится в свободном состоянии в огромных количествах. Подсчитано, что над 1га поверхности земли имеется ~ 80т азота.
Элементарный азот в клубнях некоторых растений вступает в реакцию с образованием аминокислот и белков. Но эти реакции катализируют ферменты, а необходимую энергию обеспечивает фотосинтез.
Некоторое количество азота переходит в биологически усвояемую форму в результате грозовых разрядов по реакции:
N2 + 02 → 2NO
Большинство организмов легче усваивает соединения азота со степенью окисления - 3.
Это α-аминокислоты R-CH2-NH2-COOH и их полимеры - белки. Однако скорость перевода в состояние окисления в естественных условиях слишком мала для поддержания требуемого количества связанного азота. В среднем половина необходимого для жизни азота возвращается через атмосферу за 108 лет (для кислорода - 3000 лет, углерод - 100 лет).
Сырьем для получения продуктов азотной промышленности является атмосферный воздух и различные виды топлива.
В воздухе: 79% N2+ 21% O2 (по объему), N2 - сырье для получения NH3, цианидов и др.
Ресурсы атмосферного воздуха огромны, поэтому сырьевая база азотной промышленности определяется топливом. Топливо необходимо для получения водорода ил водородсодержащего газа.
Основные реакции получения водорода для синтеза NH3:
СН4 + 0,5О2 ↔ СО + 2Н2 + 35,6 кДж
СН4 + Н2О ↔ СО + ЗН2 - 206кДж
СН4 + СО2 ↔2СО + 2Н2 - 248кДж
Одновременно протекает реакция: СО + Н2О ↔ СО2 + H2 + Q
Конверсия CH4
1) Паровая конверсия (конверсия водяным паром):
СН4+ Н2О ↔СО+ ЗН2 - 206кДж tο = 800°
2) Конверсия СН4 кислородом в две стадии:
а) СН4 + 0,5О2↔ СО + 2Н2 + 347кДж,
СН4 + 2О2 → СО2 + 2Н2О + 800кДж
б) СН4 + Н2О ↔СО + ЗН2 - 206кДж,
СН4 + СО2↔2СО + 2Н2-248кДж
3) парокислородная, парокислородновоздушная, паровоздушная конверсия (процесс называется парокислородным).
Очистка конвертированного газа от оксидов
углерода
Очистка от СО2
- наиболее распространена – очистка раствором МЭА
R-NH2 + Н2О + СО2↔ (RNH3)2CO3 (карбонат)
(R-NH3)2CO3 + Н2О + СО2 ↔ 2RNH3HCO3 (бикарбонат),
где R (-OHCH2-CH2-)
Затем карбонаты и бикарбонаты при tο > 100°С диссоциируют с выделением CO2.
- очистка горячим активированным раствором К2СО3
К2СОз + СО2 + Н2О↔ 2КНСО3
Очистка газа от СО
Старый способ: очистка медноаммиачным раствором.
В настоящее время применяется метод промывки конвертированного газа жидким азотом, который растворяем СО, СН4, Аr.
Тонкая очистка от СО и СО2 проводится каталитическим гидрированием этих соединений до метана (метанирование)
СО + ЗН2↔СН4 + H2O + 206кДж
СО2 + 4Н2↔ СН4 + 2Н2О - 165кДж
Катализатор – никель- алюминиевый
Основы производства синтетического аммиака
Аммиак является важнейшим и практически единственным соединением азота, производимым в промышленных масштабах из азота атмосферы. Таким образом, его следует рассматривать как полупродукт для получения всех остальных соединений азота.
Технологические свойства аммиака
Аммиак NH3 — бесцветный газ с резким запахом с температурой кипения -33,35°С и температурой плавления -77,75°С.
Аммиак — ключевой продукт для получения многочисленных азотсодержащих веществ, применяемых в промышленности, сельском хозяйстве и быту. На основе аммиака в настоящее время производятся практически все соединения азота, используемые в качестве целевых продуктов и полупродуктов неорганической и органической технологии. На рис. 4 представлены основные направления использования аммиака в промышленности и сельском хозяйстве.
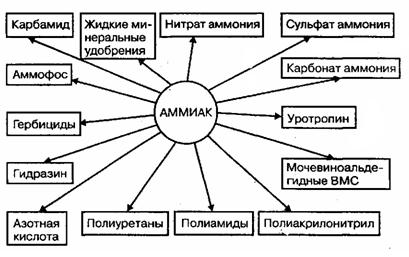
Рис. 4. Использование аммиака
Производство аммиака в РФ составило в 2008 году 12,7 млн.т.
Сырьем в производстве аммиака является азотоводородная смесь (АВС) стехиометрического состава N2:H2=1:3. Так как ресурсы атмосферного азота практически неисчерпаемы, сырьевая база аммиачного производства определяется вторым компонентом смеси — водородом, который может быть получен разделением обратного коксового газа, газификацией твердого топлива, конверсией природного газа.
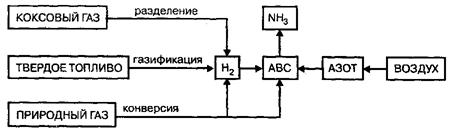
Рис.5. Сырьевые ресурсы производства аммиака
Структура сырьевой базы производства аммиака менялась и сейчас свыше 90% аммиака вырабатывается на основе природного газа.
Таблица 2
Изменение сырьевой базы производства аммиака
| Виды сырья | Доля сырья по годам, % | Энергоемкость, тонн усл. топлива | ||||
| Твердое топливо | 32,0 | 15,9 | 10,4 | 5,7 | 1.5 | 3,73 |
| Коксовый газ | 32,1 | 18,2 | 14,2 | 11,7 | 5,3 | 2,07 |
| Природный газ | 16,3 | 59,9 | 72,3 | 79,6 | 92,2 | 1,50 |
Азотоводородная смесь, независимо от метода ее получения, содержит примеси веществ, некоторые из которых являются каталитическими ядами, вызывающими как обратимое (кисло род, оксиды углерода, пары воды), так и необратимое (различные соединения серы и фосфора) отравление катализатора.
С целью удаления этих веществ ABC подвергается предварительной очистке, методы и глубина которой зависят от их природы и содержания, то есть от способа производства ABC. Обычно, ABC, получаемая конверсией природного газа, содержит
оксид углерода (IV), метан, аргон, следы кислорода и до 0,4%
об. оксида углерода (II).
Для очистки ABC в промышленности используются методы абсорбции жидкими поглотителями (мокрый метод) и адсорбции твердым поглотителем (сухой метод). При этом процесс очистки может производиться на различных стадиях производства.
Синтез аммиака - один из наиболее совершенных химико-технологических процессов. Он описывается реакцией взаимодействия: азота с водородом:
N3 + 3H2 «2NH3 + 21,8 ккал
Эта реакция обратима. Она протекает с уменьшением объема (из четырех объемов азотоводородной смеси получается два объема аммиака) и выделением тепла. Следовательно, основываясь на принципе Ле-Шателье, для того чтобы сдвинуть равновесие реакции в сторону образования аммиака, необходимо проводить процесс при высоких давлениях и низких температурах, высокой концентрации азота и водорода в газе, поступающем на синтез. Чем выше давление и ниже температура, тем выше концентрация аммиака в синтез-газе. Исходя из этого все промышленные установки синтеза-аммиака работают при давлениях, исчисляемых сотнями атмосфер. Что касается температуры, то при низких температурах скорость реакций настолько мала, что реакция практически не протекает. Поэтому для того, чтобы реакция проходила с выгодной для промышленности скоростью, необходимо повышение температуры. Оптимальной температурой, при которой будут достаточно высокими скорость реакции и степень превращения азотоводородной смеси в аммиак; оказалась температура около 500°С. Но и этого недостаточно для проведения процесса с большой скоростью. В этом случае, как и в ряде других (например, при окислении двуокиси серы), ускорить реакцию можно с помощью катализатора - железа в виде губчатых кусочков или таблеток с добавками окислов алюминия и калия для придания высокой и стабильной активности.
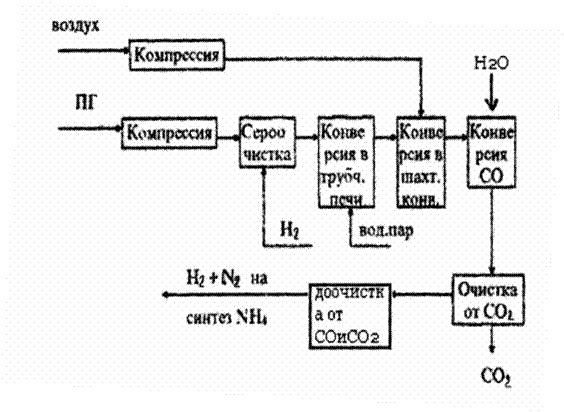
Рис. 6. Принципиальная схема производства сырья для
синтетического аммиака.
Промышленные установки синтеза аммиака работают при различных давлениях. В зависимости от используемого давления различают системы низкого давления (100 aт), среднего давления (200—550 aт) и высокого давления (600—1000 aт).
На всех установках образующийся при синтезе аммиак выделяют охлаждением газа. При этом газообразный аммиак переходит в жидкое состояние. Температура, до которой нужно охладить газ для сжижения аммиака, зависит от давления. Чем ниже давление, тем более низкая температура требуется для выделения аммиака. Например, при давлении 1000 aт можно ограничиться охлаждением газа до 40° С, а при 100 aт необходима весьма низкая температура—около—60° С. Применение высоких давлений позволяет ускорить реакцию, уменьшить размеры аппаратуры. Таким образом, применение высоких давлений имеет ряд преимуществ. Однако с повышением давления увеличивается расход энергии на сжатие газа и быстрее изнашивается аппаратура.
Исходя, из этого наибольшее распространение получили установки среднего давления, на которых эффективно осуществляется процесс выделения аммиака, достигается высокая скорость синтеза. Поэтому далее будет рассмотрена лишь схема синтеза аммиака при среднем давлении.

Рис. 40. Схема синтеза аммиака:
/ — колонна синтеза аммиака, 2 — водяной конденсатор, 3 — сепаратор, 4 — циркуляционный насос, 5 — фильтр, 6 — конденсационная колонна, 7 — испаритель
 2014-02-02
2014-02-02 3576
3576
