План лекции.
1. Общая характеристика реакционной способности альдегидов, кетонов, карбоновых кислот и их функциональных производных.
2. Механизм реакции АN
3. Биологически важные реакции альдегидов. Пиридоксальный катализ. Образование внутренних полуацеталей.
4. Окисление и восстановление альдегидов и кетонов.
5. Механизм нуклеофильного замещения карбоновых кислот и их производных.
6. Гидролиз сложных эфиров, как реакции SN Sp2 гибридизованного атома углерода.
7. Биологичесмкое значение тиоэфиров карбоновых кислот.
8. Важнейшие органические производными угольной кислоты.
 О
О
Соединения, содержащие – С -, в зависимости от характера заместителей делятся на следующие классы: альдегиды, кетоны, карбоновые кислоты и их функциональные производные.
В альдегидах, наряду с углеводородным радикалом карбонильная
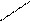 О
О
 группа связана с водородом – С, в кетонах оба замеcтителя имеют
группа связана с водородом – С, в кетонах оба замеcтителя имеют
Н
углеводородную природу. В карбоновых кислотах карбонильная группы входит в состав карбоксильной группы СООН, то есть всегда связана с гидроксильной группой.
Наиболее важными производными карбоновых кислот являются соли R – СООNa, сложные эфиры 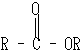 тиоэфиры
тиоэфиры


 O O О
O O О
R – C – S – R, амиды R – C – NH2, амиды, R – C –Cl, хлорангидриды ангидриды
 О
О
 R – C
R – C
 O
O
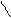 R – C
R – C
O
 Также к функциональным производным можно отнести нитрилы R – C = N, угольная кислота O
Также к функциональным производным можно отнести нитрилы R – C = N, угольная кислота O
HO – C – OH
Рассмотрение реакцтонной способности соединений с карбонильной группой начнем с реакционной способности альдегидов и кетонов.

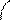
 б-О n – основное (центр протонирования)
б-О n – основное (центр протонирования)
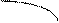

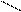
 СН2 – б+С
СН2 – б+С

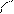 Н Н Электрофильный центр (нуклеофильная атака)
Н Н Электрофильный центр (нуклеофильная атака)
СН – кислотный центр (реакции конденсации)
Общая схема реакции

 О Y- O-
О Y- O-
 R – C – X R – C – Y
R – C – X R – C – Y

 O Y- O
O Y- O
 R – C – OH R – C – Y + X
R – C – OH R – C – Y + X
Реакции нуклефильного присоединения характерны альдегидам и кетонам. С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина б+ на нем в альдегидах и кетонах убывает в следующем ряду



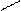 О Н R R
О Н R R
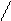
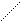

 Cl3 – C > C = O > C = O > C = O
Cl3 – C > C = O > C = O > C = O
H H R АR
Пространственная доступность карбонильного атома углерода уменьшается при замене водорода на более объемистые органические радикалы. Общая схема реакции АN в карбонильной группе включает нуклеофильную атаку по карбонильному атому углерода, за которой следует присоединение нуклеофила. Реагентами в реакции AN является НОН, R – OH, R – SH, R – NH2, HCN, NH2 – NH2.
Рассмотрим механизм AN на примере образования полуацеталей и ацеталей.

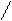 O OH
O OH


 СН3 – С + НО – С2Н5 СН3 – С – ОС2Н5
СН3 – С + НО – С2Н5 СН3 – С – ОС2Н5
Н Н полуацеталь
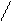
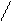 ОН H+ ОС2Н5
ОН H+ ОС2Н5
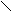
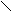
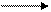 R – C – OC2H5 + HO – C2H5 R – C – O – C2H5 + H2O
R – C – OC2H5 + HO – C2H5 R – C – O – C2H5 + H2O
H H ацеталь
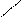
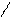 O OH H
O OH H

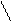

 СH3 – C + H+ CH3 – C+ + O – C2H5
СH3 – C + H+ CH3 – C+ + O – C2H5
H H


 OH H НО+ - Н
OH H НО+ - Н


 CH3 – C – O+ - C2H5 CH3 – C – O – C2H5
CH3 – C – O+ - C2H5 CH3 – C – O – C2H5
H -H+ H

 OH HO+Н
OH HO+Н
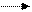



 CH3 – C – O – C2H5 + H+ CH3 – C – OC2H5 CH3 – C+ - OC2H5
CH3 – C – O – C2H5 + H+ CH3 – C – OC2H5 CH3 – C+ - OC2H5
H H -H2O H
 H
H

 H +O – C2H5
H +O – C2H5


 CH3 – C+ - C2H5 + O – C2H5 CH3 – C – OC2H5
CH3 – C+ - C2H5 + O – C2H5 CH3 – C – OC2H5
H H
 OC2H5
OC2H5

 CН3 – C – OC2H5
CН3 – C – OC2H5
-H+ H
Реакция образования ацеталей и полуацеталей обратима. Они легко гидролизируется в кислой среде на спирты и альдегиды.
 Обоснование циклических форм моносахаридов объясняется реакцией внутримолекулярной циклизации (образование внутренних полуацеталей)
Обоснование циклических форм моносахаридов объясняется реакцией внутримолекулярной циклизации (образование внутренних полуацеталей)



 Н О Н ОН
Н О Н ОН


 С С С2НОН О Н
С С С2НОН О Н




 Н – С – ОН Н – С – ОН ОН ОН
Н – С – ОН Н – С – ОН ОН ОН

 Н – С – ОН Н+ Н – С – ОН О ОН ОН
Н – С – ОН Н+ Н – С – ОН О ОН ОН


 Н – С – ОН Н – С – ОН СН2ОН ОН
Н – С – ОН Н – С – ОН СН2ОН ОН


 Н – С – ОН Н – С ОН С = О
Н – С – ОН Н – С ОН С = О
СН2ОН СН2ОН ОН ОН Н
Амины и другие азотсодержащие соединения общей формулы NH2X реагируют с альдегидами и кетонами в две стадии:


 СН3 СН3 ОН СН3
СН3 СН3 ОН СН3


 С = 0 + NН2 - ОН С С = N – OH
С = 0 + NН2 - ОН С С = N – OH
 CH3 CH3 N – OH -H2O CH3
CH3 CH3 N – OH -H2O CH3
H оксим


 СН3 СН3 ОН СН3
СН3 СН3 ОН СН3


 С = 0 + NН2 – NH2 - С C = N – NH2
С = 0 + NН2 – NH2 - С C = N – NH2
 CH3 CH3 N – NH2 -H2O CH3
CH3 CH3 N – NH2 -H2O CH3
H гидразоны
Эти реакции часто используют для идентификации альдегидов и кетонов (вещества с четкой температурой кипения). Пиридоксальфосфат кофермент взаимодействует с α – аминокислотами с образованием альдимина I путем взаимодействия альдегидной группы кофермента с аминогруппами α – аминокислот.


 H O OH
H O OH



 O C H – C – N - CH - COOH
O C H – C – N - CH - COOH


 -О – PO – CH2 OH + NH2 - CH - COOH - CH2 OH H CH3
-О – PO – CH2 OH + NH2 - CH - COOH - CH2 OH H CH3
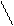 O- CH3 CH3 -Н2О
O- CH3 CH3 -Н2О

 N СН3 +N
N СН3 +N
H H

 H – C = N – CH – COOH
H – C = N – CH – COOH
О – СН2 OH CH3
CH3
 +N
+N
H
В зависимости от того, какая из этих связей будет принимать участие в дальнейшей реакции. Будут протекать биологически важные реакции α – аминокислот. То есть каждая реакция из них реализуется через альдимин I.
Восстановление карбонильной группы осуществляется по механизму нуклеофильного присоединения к карбонильному атому С.
Для восстановления альдегидов и кетонов IN VITRO наиболее часто используют гидриды металлов, в частности алюмогидрид лития [AlH4] Li.



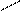 O +H эфир H H
O +H эфир H H





 CH3 – C + [ H – Al – H ] Li [ CH3 – C – O – Al – H ] Li
CH3 – C + [ H – Al – H ] Li [ CH3 – C – O – Al – H ] Li
H H H H
 HOH H
HOH H

 CH3 – C – OH + [AlH3OH] Li
CH3 – C – OH + [AlH3OH] Li
H
Формалин имеет кислую среду, так как вступает в реакцию диспропорционирования.
 О
О

 2Н – С + НОН СН3ОН + НСООН
2Н – С + НОН СН3ОН + НСООН
Н
Механизм реакции.диспропорционирования.
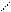
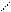
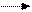

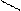


 Н Н Н О Н О -
Н Н Н О Н О -
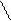
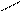


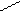 С = О + О С Н+ С – OH
С = О + О С Н+ С – OH
 H Н CH3 О – H H H анион I
H Н CH3 О – H H H анион I
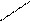

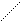
 Н О - Н О
Н О - Н О

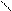

 Н2 – С = О + С Н2 – С + Н – С
Н2 – С = О + С Н2 – С + Н – С
H OH О ОН
 О - О
О - О

 СН3 – О- + Н – С СН3ОН + Н – С
СН3 – О- + Н – С СН3ОН + Н – С
ОН О-
За счет СН кислотного центра карбонильные соединения вступает в реакции альдольной конденсации.

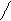
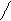 О О ОН О О
О О ОН О О





 СН3 – С + Н – СН2 - С СН3 – С – СН2 - С СН3 – СН = СН - С
СН3 – С + Н – СН2 - С СН3 – С – СН2 - С СН3 – СН = СН - С
 Н Н Н Н Н
Н Н Н Н Н
ацетальдегид
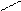
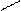

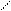 O HO- O O-
O HO- O O-
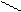

 CH3 – C CH2 – C CH2 = C
CH3 – C CH2 – C CH2 = C
H - H2O H H
карбоанион Енолят ион



 O O O- O HOH
O O O- O HOH




 CH3 – C + CH2 – C CH3 – C – CH2 – C
CH3 – C + CH2 – C CH3 – C – CH2 – C
H H H H

 OH O
OH O
 CH3 – C – CH2 – C
CH3 – C – CH2 – C
H H
В условиях организма осуществляются реакции альдольной конденсации (например, образование нейроминовой кислоты) альдольное расщепление 1,6 дифосфат Д – фруктозы.
Реакции нуклеофильного замещения характерны для карбоновых кислот и их функциональных производных. В карбоновых кислотах и функциональных производных в статическом состоянии существует основной электрофильный центр, потенциально уходящая группа СН-кислотный центр. Карбоновые кислоты способны вступать в реакции SN заменой ОН или нуклеофуга на нуклеофил. Общая схема механизма таких реакций включает образование нестабильного продукта присоединения нуклеофила к атому углерода карбонильной группы. Этот механизм называют тетраэдрическим.
Н+
 СН3СООН + С7Н5ОН
СН3СООН + С7Н5ОН


 O O- O
O O- O



 R – C +Y- R – C – Y R – C + X-
R – C +Y- R – C – Y R – C + X-
X X Y
По такому механизму протекает реакция, при наличии сильного Y и хорошо уходящей группы Х. Например, в случае щелочного гидролиза сложных эфиров. Легкость нуклеофильной атаки зависит от величины эффективного положительного заряда карбонильной группы. По реакционной способности в реакциях SN можно расположить в ряду



 O O O O O
O O O O O




 R – C < R – C < R – C < R – C < R – C
R – C < R – C < R – C < R – C < R – C
O- NH2 OR O – R Cl
В общем производные карбоновых кислот по сравнению с альдегидами и кетонами труднее подвергаются нуклеофильной атаке, так как электрофильность карбонильного атома углерода обычно снижается за счет +М эффекта функционального заместителя Х, связанного с атомом углерода карбонильной группы. По этой причине в нуклеофильных реакциях карбоновой кислоты часто подвергаются кислотному катализу. В итоге механизм состоит из слудующих стадий:
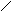


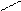
 O H+ OH Y- OH OH H+ O
O H+ OH Y- OH OH H+ O
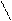







 R – C R - +C R – C – Y R – +C R – C
R – C R - +C R – C – Y R – +C R – C
X X X -X Y Y
Наиболее важной реакцией для карбоновых кислот является реакция этерификации и гидролиз сложных эфиров по механизму SN.
 CH3COOH + C2H5OH Н+ CH3COOC5H5 + H2O
CH3COOH + C2H5OH Н+ CH3COOC5H5 + H2O

 O OH H
O OH H
 CH3 – C + H+ CH3 – C+ + O – C2H5
CH3 – C + H+ CH3 – C+ + O – C2H5
OH OH

 OH H O
OH H O
 CH3 – C – O – C2H5 CH3 – C
CH3 – C – O – C2H5 CH3 – C
 OH - H+, H2O O
OH - H+, H2O O
C2H5
Также по механизму SN они подвергаются гидролизу




 COOH O H+ COOH OH
COOH O H+ COOH OH

 - O – C – CH3 + HOH + CH3COOH
- O – C – CH3 + HOH + CH3COOH
аспирин


 COOH OH COOH ОН
COOH OH COOH ОН


 - O – C+ – CH3 + HOH O – C – CH3
- O – C+ – CH3 + HOH O – C – CH3

 O - H+
O - H+
H H
 COOH
COOH
OH + CH3COOH
Никотинамид предупреждает развитие пеллагры. Получают его из хлорангидрида никотиновой кислоты по механизму SN.


 O O-
O O-



 С С – N+H3
С С – N+H3
 Cl + NH3 Cl - Cl
Cl + NH3 Cl - Cl
N N



 O O
O O


 - C NH3 C + NH4Cl
- C NH3 C + NH4Cl
NH3 H+ NH3
N N
Жиры и масла являются сложными эфирами карбоновых кислот и глицерина и подвергаются гидролизу по механизму SN.
 О
О
 СН2 – O – C – C17H33 CH2 – OH
СН2 – O – C – C17H33 CH2 – OH
 O H+
O H+

 CH – O – C – C17H33 + 3HOH CH – OH + 3 C17H33COOH
CH – O – C – C17H33 + 3HOH CH – OH + 3 C17H33COOH
 O
O
CH2 – O – C – C17H33 CH2 – OH

 ОH OH
ОH OH


 СН2 – O – C+ – C17H33 CH2 – O – C – C17H33
СН2 – O – C+ – C17H33 CH2 – O – C – C17H33
H – O+ - H

 OH OH
OH OH


 CH – O – C+ – C17H33 + HOH CH – O – C - C17H33
CH – O – C+ – C17H33 + HOH CH – O – C - C17H33
H – O+ - H

 OH OH
OH OH
 CH2 – O – C+ – C17H33 CH2 – O – C – C17H33
CH2 – O – C+ – C17H33 CH2 – O – C – C17H33
H – O+ - H

 CH2 – OH
CH2 – OH

 - 3H+ CH – OH + 3 C17H33COOH
- 3H+ CH – OH + 3 C17H33COOH
CH2 – OH
Биологическиое значение тиоэфиров карбоновых кислот:
 О
О
Ацетилкофермент А СН3СОО – SКоА служит переносчиком ацетильной группы на нуклеофильный субстрат.

 O O
O O
CH3 – C – SКоA + HOR CH3 – C – OR + HSКоA
 SAM CH3
SAM CH3

 HO – CH2 – CH2 – NH2 HO – CH2 – CH2 – +N – CH3 +
HO – CH2 – CH2 – NH2 HO – CH2 – CH2 – +N – CH3 +
CH3


 O O CH3
O O CH3

 CH3 – C – SКоA CH3 – C – O – CH2 – CH2 – +N – CH3
CH3 – C – SКоA CH3 – C – O – CH2 – CH2 – +N – CH3
-HSКоA CH3
ацетил кофермент А ацетилхолин
Ацетил кофермент обладает большей способностью к нуклеофильному замещению. Это обусловлено с одной стороны, меньшим +М. Эффективный положительный заряд на карбонильном углероде в тоэфирах выше, чем в сложных эфирах. Ацетилфосфаты играют важную роль в биохимических процессах как переносчики ацильных групп.



 O O O O-
O O O O-

 CH3 – C – O P – OH CH3 – C P – OR
CH3 – C – O P – OH CH3 – C P – OR
OH OH



 O O O
O O O


 R – C P – OR, + ROH R – C – OR
R – C P – OR, + ROH R – C – OR
 O- O
O- O
 RSH R – C – SR
RSH R – C – SR
 O
O
 RNH2 R – C - NHR
RNH2 R – C - NHR
Непременными участниками реакций по типу альдольного присоединения IN VIVO являются тиоэфиры карбоновых кислот производным которого является кофермент А.



 O O OH O
O O OH O


 CH3 – C + H – CH2 – C CH3 – C – CH2 – C
CH3 – C + H – CH2 – C CH3 – C – CH2 – C
SКоA SКоA SКоA SКоA

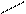 O O
O O
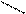 CH3 – C – CH2 – C + HSКоA
CH3 – C – CH2 – C + HSКоA
SКоA
Другая важная реакция ацетилкофермента А.




 O O фермент OH O HOH
O O фермент OH O HOH



 R C - COOH + HCH2 – C R – C – CH2 – C -О НSНОН
R C - COOH + HCH2 – C R – C – CH2 – C -О НSНОН
SКоA COOH SКоA
 OH
OH
 R – C – CH2 – COOH
R – C – CH2 – COOH
COOH
производные угольной кислоты

 O O
O O
HO – C – OH NH2 – C – NH2
Фермент мочевины под действием уреазы
 О
О
 NН2 – С – NН2 + НОН СО2 + 2NН3
NН2 – С – NН2 + НОН СО2 + 2NН3
При медленном нагревании до 150-160оС



 О О О О
О О О О
 NН2 – С – NН2 + NН2 – С – NН2 NН2 – С – NН – С – NН2
NН2 – С – NН2 + NН2 – С – NН2 NН2 – С – NН – С – NН2
Образует хелат (беуретовая реакция) биурет
Широкое распространение в качестве лекарственных средств действующих на центральную нервную систему получили барбитураты (уреиды молоновой кислоты)
 O
O
NH
 NH O O
NH O O
 NH2 – C – NH2 N
NH2 – C – NH2 N
H
Гуанидин барбитуровая кислота
 2014-02-13
2014-02-13 2210
2210
