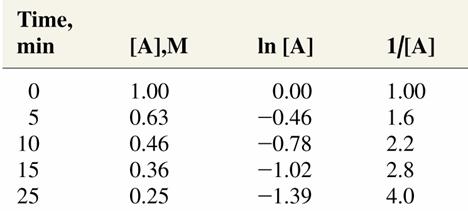
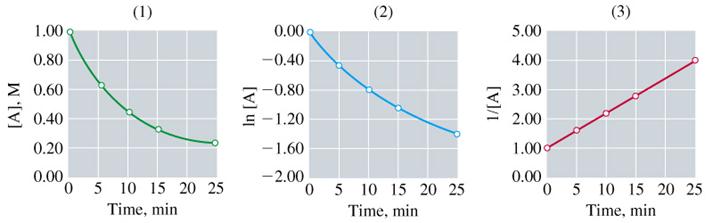
В случае (3) имеем линейную зависимость, т.е. реакция второго порядка.
Определение порядка реакции
 | |||||
 |  | ||||
В случае многих химических реакций, которые протекают при температурах, близких к комнатной, скорость реакции при повышении температуры возрастает.
Согласно эмпирическому правилу Вант-Гоффа при повышении температуры на 10 градусов скорость реакции возрастает в 2...4 раза:
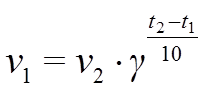
где v1 и v2 – скорости реакции при температуре t1 и t2 и g - температурный коэффициент константы скорости реакции (зависит от температуры!).
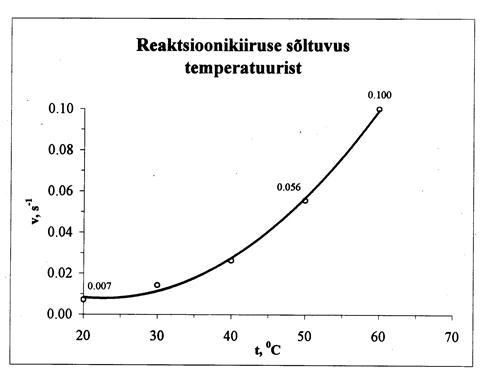
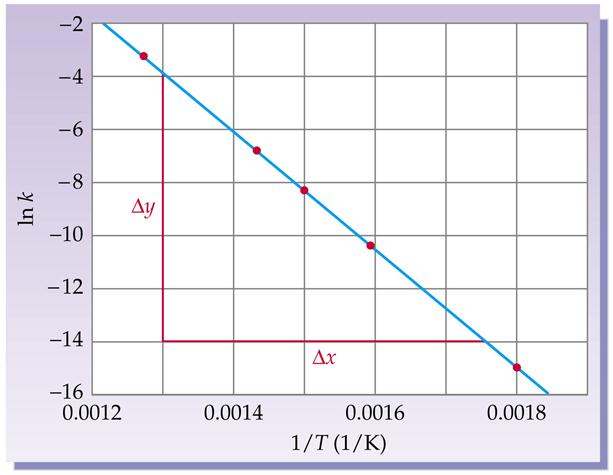
Зависимость скорости реакции от температуры является экспоненциальной и ее описывает эмпирическое уравнение Аррениуса:
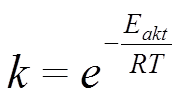
где Eakt - энергия активации,
k константа скорости реакции,
R – универсальная газовая постоянная.
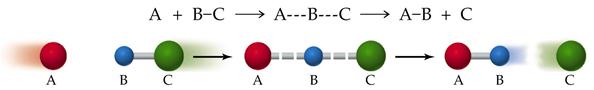
Химические реакции протекают через определенное активированное состояние
(т.н. активированный комплекс), энергия которого выше, чем энергия исходного и конечного состояния.
Энергия активации равна энергии, необходимой для достижения данного состояния.
Энергия активации необходима:
· для ослабления химических связей,
· деформации молекулы,
· преодоления взаимного отталкивания частиц.
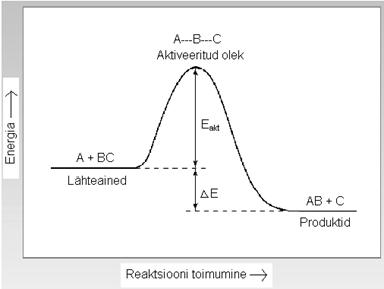
Влияние повышения температуры на скорость реакции состоит в увеличении числа молекул с большей (повышенной) энергией.
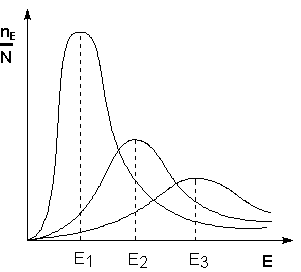
Распределение частиц по энергии. Здесь nЕ/N – доля частиц, обладающих энергией E; Ei - средняя энергия частиц при температуре Ti (T1 < T2 < T3)
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции.
Интегральная форма уравнения Аррениуса:
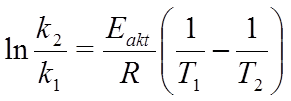
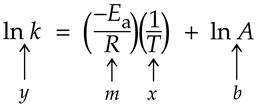
 2014-02-09
2014-02-09 1181
1181








